Вам відомо, що при змішуванні речовин з водою утворюються як однорідні системи (характерна властивість розчинів), так і неоднорідні суміші. Чи замислювались ви над тим, чому одні речовини з водою утворюють однорідну систему, а інші – неоднорідну? Щоб відповісти на це запитання треба з’ясувати, що відбувається в процесі розчинення речовин у воді.
Під час розчинення речовини подрібнюються, тому істинні розчини, а також суспензії й емульсії належать до дисперсних систем (диспергування означає подрібнення). Дисперсних систем існує багато. Вони розрізняються між собою в залежності від того, на які частинки (тверді, рідкі, газоподібні) та в якому середовищі (рідкому, газоподібному) вони розподілені. Так, наприклад, одна з дисперсних систем – дим складається із суміші газів і дуже подрібнених частинок твердої речовини. Туман – дисперсна система, де середовищем може бути повітря, а диспергованими частинками – дрібні краплі рідини. Піни – дисперсні системи, де середовищем є рідина, а диспергованою речовиною – газ. Подібну систему можуть утворювати суміші різних речовин в різному агрегатному стані.

Приклади дисперсних систем: а – дим, б – туман, в – піна
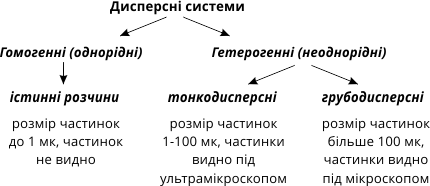
Найбільш поширені в природі дисперсні системи, в яких дисперсним середовищем є рідина, а дисперсною фазою – тверда речовина. В залежності від розміру частинок твердої речовини дисперсні системи поділяються на грубодисперсні (зависі і неоднорідні суміші з розмірами частинок більше 1 мк) і на тонкодисперсні (колоїдні) системи. Якщо частинки розподіленої у системі речовини мають розмір молекул або йонів, то виникає гомогенна система – розчин.
Дисперсні системи бувають газуваті, рідкі й тверді. Агрегатні стани розподіленої речовини і середовища, а також розміри частинок визначають властивості дисперсних систем. Якщо розподілені частинки за розмірами значно більші, ніж молекули, то дисперсна система є певною мірою нестійкою. Вона поступово стає неоднорідною: розподілена речовина, залежно від її питомої ваги, підіймається на поверхню або ж випадає в осад. Процес осідання частинок здійснюється тим швидше, чим більш грубодисперсною є система.
Дисперсні системи, що містять великі частинки (понад 100 мк), називаються зависями (каламутні суміші).
Після зливи, наприклад, вода в річці скаламучена через збурені частинки мулу. Вода поступово очищається внаслідок осідання твердих частинок.
Частинки більшості зависей можна спостерігати під мікроскопом. Залежно від агрегатного стану диспергованої речовини такі системи поділяються на суспензії та емульсії. Дисперсні системи, що являють собою рідину, в якій розподілені тверді речовини, називаються суспензіями (наприклад суміш води з глиною). Якщо в одній рідині розподілені краплинки іншої рідини, то такі системи називаються емульсіями. Наприклад, емульсії утворюються при збовтуванні гасу, бензину, олії з водою.

а) молоко (емульсія); б) суміш води з кавовим напоєм (суспензія)
Існують також складні дисперсні системи, наприклад, молоко. Воно містить розчинній у воді молочний цукор і дисперговані в цьому розчинні казеїн та жир. З часом жир піднімається на поверхню у вигляді вершків, а казеїн виділяється у вигляді сиру, коли молоко скисає.
Дисперсні системи, які містять частинки розмірами від 1 до 100 мк. називаються колоїдними розчинами або золями (клеєподібні). Частинки колоїдних розчинів можна бачити тільки за допомогою ультрамікроскопів.

Клей – колоїдний розчин
Процес збільшення розмірів колоїдних частинок називається коагуляцією або згортанням. У колоїдних розчинах коагуляція відбувається дуже повільно. Якщо частинки мають порівняно великі розміри, вони починають швидко випадати в осад, тому ліки, які є суспензіями чи емульсіями, перед прийманням рекомендують збовтувати.
Якщо розподілена речовина міститься в дисперсній системі у вигляді окремих молекул або іонів, то така система є дуже стійкою, вона зберігається досить тривалий термін і називається істинним (молекулярним або іонним) розчином.
Розмір частинок у молекулярних розчинах не перевищує 1 мк, саме тому істинні розчини називають однорідними системами, бо їх неоднорідність не можна виявити навіть за допомогою ультрамікроскопа.
Багато газів, рідин і твердих речовин розчиняється у воді. Цукор і кухонна сіль легко розчиняються у воді; вуглекислий газ, амоніак та багато інших речовин, стикаючись з водою переходять у розчин і втрачають свій попередній агрегатний стан. Розчинену речовину певним способом можливо виділити з розчину. Якщо випарити розчин кухонної солі, то сіль залишиться у вигляді твердих кристалів.
При розчиненні речовин у воді (чи іншому розчиннику) утворюється однорідна (гомогенна) система. Таким чином, розчином називається гомогенна система, що складається з двох або більшої кількості компонентів. Розчини можуть бути рідкими, твердими і газоподібними. До рідких розчинів належать, наприклад, розчин цукру або кухонної солі у воді, спирту у воді тощо. До твердих розчинів одного металу в іншому відносяться сплави: латунь – це сплав міді і цинку, бронза – сплав міді й олова тощо. Газоподібним розчином є повітря або взагалі будь-яка суміш газів.

Розчин цукру у воді
Наведений поділ між різними розчинами є умовним, різких меж між ними немає.
Підсумок:
- Гетерогенність суспензій і золей пояснюється тим, що тверда речовина, частинки якої розміщені в рідині, не розчиняються в ній.
- В залежності від розчинника розчини бувають водні і неводні (наприклад, спиртовий розчин йоду).
- Злипання колоїдних частинок і їх осідання в розчині називають коагуляцією.
- За агрегатним станом розчинної речовини розчини поділяються на: тверді (наприклад, сплави), рідкі (наприклад, чай), газоподібні (наприклад, суміш газів, повітря).
?
- Які системи називаються дисперсними?
- Що таке емульсія? Наведіть приклад.
- Що таке суспензія? Наведіть приклад.
- Наведіть приклади колоїдних та істинних розчинів.
Для допитливих
● Колоїдні розчини дуже поширені в природі і відіграють важливу роль у фізіологічних процесах. Так, білок яйця, плазма крові – колоїдні розчини, в яких відбуваються фізіологічні процеси.
● Велике значення мають колоїдні розчини ґрунту.
● Значна роль колоїдних розчинів у виробництві. Різноманітні клеї, лаки, фарби – це в основному колоїдні розчини. Такі фарби мають кращу покривну здатність.
● Речовини в колоїдному стані використовують як каталізатори.
Експериментуємо
«ХОЛОДЕЦЬ»
Силікатна кислота існує у вигляді колоїдного розчину. Це дає змогу проробити цікавий дослід. До розчинного скла добавте такий самий об’єм дистильованої води. При цьому утворюється 10% розчин солі. Потім добавте половину об’єму розведеної (1:1) хлоридної кислоти. Доливши кислоту, швидко перемішайте рідину. Прозорий розчин майже відразу стає каламутним і перетворюється на масу, схожу на холодець.


















