Є багато вуглеводнів схожих на метан, тобто гомологів метану (гр. gomolog – «схожий»). В молекулах цих речовин є два, три, чотири й більше атомів Карбону, сполучених з атомами Гідрогену. Такі сполуки, які складаються з атомів Карбону й Гідрогену називаються вуглеводнями. Вуглеводні, у яких атоми Карбону сполучені між собою простими зв’язками, а решта валентностей насичені атомами Гідрогену, називаються насиченими.
Кожний наступний вуглеводень відрізняється від попереднього групою атомів – СН2, яку називають гомологічною різницею. Наприклад, якщо до молекули метану СН4 добавити гомологічну різницю СН2, то дістанемо наступний вуглеводень ряду метану – етан С2Н6. Гомологи розташовані у порядку зростання їх відносної молекулярної маси, утворюють гомологічний ряд.
Таблиця 7. Гомологічний ряд метану
|
Агрегатний стан, tпл. °С |
Гомологічний ряд |
Назва |
Напівструктурна формула |
Число ізомерів |
|
Газ – 182,5 |
СН4 |
метан |
|
– |
|
Газ – 173,3 |
С2Н6 |
етан |
СН3–СН3 |
– |
|
Газ – 187,7 |
С3Н8 |
пропан |
СН3–СН2–СН3 |
– |
|
Газ – 138,3 |
С4Н10 |
бутан |
СН3–СН2–СН2–СН3 |
2 |
|
Рідина – 129,7 |
С5Н12 |
пентан |
СН3–(СН2)3–СН3 |
3 |
|
Рідина – 95,3 |
С6Н14 |
гексан |
СН3–(СН2)4–СН3 |
5 |
|
Рідина – 90,6 |
С7Н16 |
гептан |
СН3–(СН2)5–СН3 |
9 |
|
Рідина – 56,8 |
С8Н18 |
октан |
СН3–(СН2)6–СН3 |
18 |
|
Рідина – 53,5 |
С9Н20 |
нонан |
CH3–(CH2)7–CH3 |
35 |
|
Рідина – 29,6 |
С10Н22 |
декан |
СН3–(СН2)8–СН3 |
75 |
|
Тверда речовина |
С16Н34 |
|
|
С11 – 159 |
Ряд вуглеводнів, які відповідають одній загальній формулі, мають подібну будову молекул й подібні хімічні властивості й різняться між собою на одну чи кілька груп СН2, називають гомологічним рядом.
Будова насичених вуглеводнів
Електронна й просторова будова членів гомологічного ряду насичених вуглеводнів схожа на будову молекули метану. Гібридизовані електронні хмари атомів Карбону направлені до вершин тетраедра, молекула етану побудована із двох сполучених між собою карбонових тетраедрів, молекула пропану – з трьох, і т. д., тому карбоновий ланцюг набуває зигзагоподібної форми. У молекулі навколо простих карбон-карбонових зв’язків за нормальних умов можливе вільне обертання. Внаслідок цього молекула може набувати різних форм.
СnН2n+2 –ан.
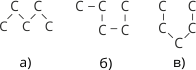
Рис. 46. Різні просторові форми карбонових ланцюгів.
Слід пам’ятати, якої б форми не набув карбоновий ланцюг, послідовність сполучення атомів в усіх випадках залишається тією самою, що й виражається структурною формулою.
Фізичні властивості насичених вуглеводнів
Нижчі насичені вуглеводні – метан, етан, пропан, бутан – безбарвні гази без запаху або із слабким запахом бензину. Алкани від пентану до пентадекану (С15Н32) – рідини, а алкани від С16Н34 при звичайних умовах – тверді речовини. Алкани з розгалуженою будовою мають нижчу температуру кипіння в порівнянні з їх нерозгалуженими ізомерами. Алкани не розчиняються у воді але розчинні в органічних розчинниках. Рідкі алкани є високоякісними розчинниками.
Хімічні властивості насичених вуглеводнів
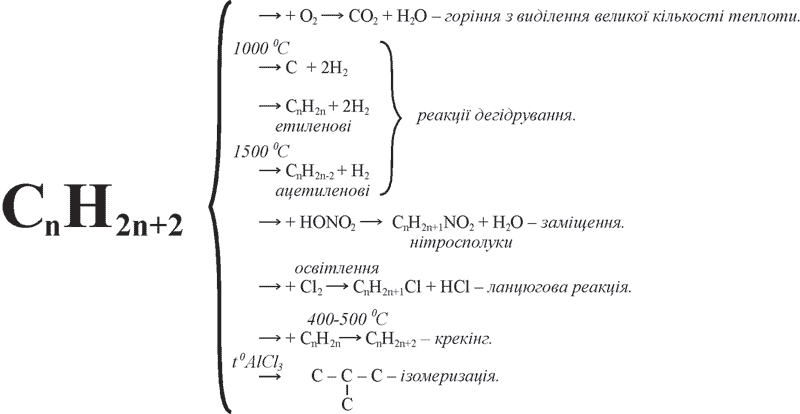
Насичені вуглеводні хімічно інертні, оскільки всі валентності в їх молекулах насичені. Найхарактернішими реакціями насичених вуглеводнів є реакції заміщення. Знаючи хімічні властивості одного із членів гомологічного ряду, можна передбачити хімічну поведінку інших членів цього ряду. За хімічними властивостями ці вуглеводні дуже схожі на метан: горять, розкладаються при нагріванні, вступають в реакції заміщення з хлором, не вступають в реакції приєднання.
1. Усі насичені вуглеводні горять блідим синюватим полум’ям, утворюючи вуглекислий газ і воду. Наприклад, горіння етану:
2С2Н6 + 7О2 → 4СО2 + 6Н2О.
2. Взаємодія з хлором. Під дією світлової енергії молекули хлору розкладаються на хімічно дуже активні атоми й відбуваються ланцюгові реакції до послідовного повного заміщення атомів Гідрогену у насичених вуглеводнів.
І стадія C2H6 (етан) +CI2 → C2H5CI (хлоретан) + HCI
ІІ стадія C2H5CI (хлоретан) + CI2 → C2H4CI2 (дихлоретан) + HCI
ІІІ стадія C2H4CI2 (дихлоретан) + CI2 → C2H3CI3 (трихлоретан) + HCI
і т.д.
3. Термічний розклад відбувається при сильному нагріванні без доступу кисню. Ці реакції ще називають реакціями дегідрування (відщеплення Гідрогену):
а) розклад бутану: С4Н10 (бутан) ![]() С4Н8 (бутен) + Н2;
С4Н8 (бутен) + Н2;
б) розклад етану: С2Н6 ![]() 2С + 3Н2;
2С + 3Н2;
в) розклад бутану: С4Н10 (бутан) ![]() С4Н6 (бутин) + 2Н2.
С4Н6 (бутин) + 2Н2.
4. Для насичених вуглеводнів відомі реакції, під час яких відбувається розрив ланцюга атомів Карбону (крекінг), при цьому утворюються алкани з меншою кількістю атомів Карбону й ненасичені сполуки. Наприклад, крекінг бутану:
С4Н10 (бутан) → С2Н6 (етан) + С2Н4 (етен).
Розщеплення молекул органічних сполук під дією високих температур та наявності каталізатора, яке супроводжується руйнуванням зв’язків С–С й утворенням речовин з меншою молекулярною масою, називається крекінгом.
5. Вуглеводні нормальної будови під впливом каталізаторів, при нагріванні ізомеризуються й перетворюються у вуглеводні розгалуженої будови:
Ізомеризуватися можуть лише вуглеводні, які містять не менше чотирьох атомів Карбону.
Схема 6. Хімічні властивості насичених вуглеводні
Велике промислове значення має окиснення вищих насичених вуглеводнів з числом атомів Карбону 20-25. Таким способом добувають синтетичні жирні кислоти з різною довжиною ланцюга, які використовуються для виробництва мил, різних миючих засобів, мастил, лаків та емалей. Рідкі вуглеводні складу С7 … С17 використовують як паливо, розчинники. Алкани широко застосовують в органічному синтезі.
Підсумок:
- Загальна формула насичених вуглеводнів – СnН2n+2, закінчення –ан.
- Вуглеводні, у молекулах яких атоми Карбону сполучені між собою простими зв’язками, а решта валентностей насичена атомами Гідрогену, називають насиченими, або алканами чи парафінами.
- Гомологічна різниця – це група атомів – СН2.
- Хлорування вищих вуглеводнів відбувається більш спокійно.
?
- Які сполуки називають вуглеводнями?
- Який елемент становить основу вуглеводнів?
- Зобразіть електронну формулу етану. Як утворюються хімічні зв’язки в молекулі?
- Яка гібридизація характерна для насичених вуглеводів?
- Які сполуки називаються насиченими вуглеводнями?
- Які речовини називаються гомологами?
- Що показує структурна формула?
- Охарактеризуйте значення гомологів метану в народному господарстві.
Для тих, хто хоче знати більше
Добування насичених вуглеводнів
Промислові методи
- Перегонка нафти.
- Гідрування бурого вугілля.
- Із синтез–газу: СО + 3Н2 → СН4 + Н2О.
- Взаємодією вуглецю з воднем: С + 2Н2 → СН4.
У лабораторії
- Гідрування ненасичених вуглеводнів в присутності каталізатора Ni або Pt за схемою: СnН2n+ Н2 → СnН2n+2.
Наприклад: С2Н4 + Н2→ С2Н6. - Взаємодією активних металів з галогенопохідними (реакція Вюрца) за схемою: 2R–Г + Me → СnН2n+2 + MeГ.
Наприклад: 2CH3I + 2Na → C2H6 + 2NaI. - Нагрівання натрій ацетату з твердим лугом:
CH3COONa + NaOН → Na2CО3 + CH4. - Гідроліз алюміній карбіду:
AI4C3 + 12H2O → 4AI(OH)3 +3 CH4.