Найважливішими представниками цієї групи речовин є метиловий CH3OH та етиловий C2H5OH спирти.
CnH2n+1OH
Склад, структурні формули метанолу та етанолу
функціональна група– OH.
Заміщуючи атом Гідрогену в молекулі метану CH4 на функціональну групу – OH, дістанемо формулу метанолу CH3OH. Заміщуючи атом Гідрогену в молекулі етану C2H6 на функціональну групу – OH, дістанемо формулу етанолу – C2H5OH. У цих сполуках вуглеводневий радикал метил – CH3 й етил – С2H5 з’єднані з гідроксильною групою – OH.
CnH2n+1 радикал (R)
Наявність гідроксильної групи є ознакою речовин класу спиртів. Саме ця група атомів зумовлює хімічні властивості спиртів і називається тому функціональною.
У молекулі етилового спирту атоми сполучені між собою ковалентними σ-зв’язками. Електронна формула його має будову:
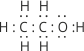
На відміну від вуглеводнів у молекулі спирту не рівномірний розподіл електронної густини. Зв’язок O–H полярний, атом Оксигену як найбільш електронегативний елемент у цій речовині відтягує на себе електронну густину від атома Гідрогену й набуває частково негативного заряду (δ– дельта мінус), атом Гідрогену частково позитивного заряду (δ+ дельта плюс). У результаті цього атом Гідрогену групи OH стає рухливіший, він ніби менш зв’язаний з молекулою, а тому легко витискується атомами активних металів. Вуглеводневий радикал відштовхує від себе електронну густину, що призводить до посилення частково негативного заряду на атомі Оксигену. Зміщення електронної густини можна показати у формулі так:
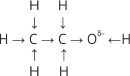
Аналогічну будову має метанол CH3→ Oδ–← Hδ+.
Будову цих молекул можна представити за допомогою моделей:
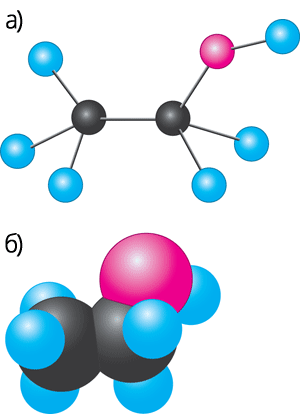
Рис. 54. Моделі молекул.
а) масштабна етанолу; б) кулестержнева етанолу.
Фізичні властивості
Метанол та етанол рідини, які змішуються з водою в будь-яких співвідношеннях. Це пояснюється сильною асоціацією молекул спирту в рідкому стані за рахунок утворення досить міцних водневих зв’язків між молекулами спирту, а в разі розчинення у воді між молекулами спирту та молекулами води. Зазвичай водневий зв’язок позначають крапками і цим зазначають, що він набагато слабкіший, ніж ковалентний зв’язок.
а) водневий зв’язок між молекулами спирту
б) водневий зв’язок між молекулами спирту й води
Метанол і етанол – дуже подібні рідини, розрізнити їх можна лише хімічним способом або за температурою кипіння: метанол –64,5°С, етанол –78,3°С.
Застосування
Найбільше значення із насичених одноатомних спиртів мають метанол та етанол.
Метанол широко використовується як розчинник та як сировина для багатьох органічних синтезів: а) для добування формальдегіду, необхідного для виробництва пластмас; б) барвників; в) фотореактивів; г) фармацевтичних препаратів.
Перспективним є використання метанолу, як пального для двигунів, оскільки добавка його до бензину підвищує октанове число і знижує утворення шкідливих речовин у вихлопних газах. Він широко використовується в промисловості в якості розчинника для лаків, барвників.
У водних розчинах концентрацію етанолу іноді виражають в об’ємних відсотках, які називають градусами.
Вперше його добули шляхом сухої перегонки деревини, тому його ще називають деревним спиртом. Метанол діє на нервово-судинну систему як отрута, тому на посудинах, в яких міститься спирт залишають підпис «метанол – отрута».
Етанол – багатотонажний продукт хімічної промисловості. За об’ємом виробництва він посідає перше місце серед інших органічних продуктів. У великих кількостях його використовують для добування синтетичного каучуку й виробництві пластмас, як розчинник для виготовлення духів, одеколонів, консервування анатомічних препаратів. Його застосовують для добування багатьох органічних речовин: діетилового етеру, барвників, бездимного пороху, харчової оцтової кислоти, фотоплівки та інше. В деяких країнах його використовують в суміші з бензином як пальне для двигунів внутрішнього згорання.
Етиловий спирт, одержаний з тирси (гідролізний спирт), містить деяку кількість метанолу, який є дуже отруйним, тому його застосовують тільки для технічних потреб. Дуже часто його денатурують, тобто додають інші речовини чи барвники, щоб зробити його непридатним для вживання.
Таблиця 13. Метанол та етанол як представники одноатомних спиртів
|
Ознаки для порівняння |
СН3OH – метанол (карбінол, деревний спирт). |
С2H5OH – етанол (медичний спирт, винний спирт). |
|
Фізичні властивості |
Безбарвна рiдина, без кольору, добре розчинна у водi, tкип. – +65°С. Дуже отруйний. |
Безбарвна рідина, має специфічний запах, необмежено розчинна у воді, tкип. – +78,5°С. |
|
Фізіологічна дія на організм |
Метанол нервово-судинна отрута. Навiть невеликi кiлькості вражають зоровий нерв й сiтківку ока. У разі потрапляння спирту в організм 10 мл спричиняє сліпоту, а 25 мл – смерть. |
Етанол – наркотик, що в невеликих дозах спричиняє сп’яніння, а у великих – викликає різні захворювання. |
|
Добування |
1. Суха перегонка деревини. 2. Із синтез – газу: |
Біохімічний метод: 1. Спиртове бродіння цукристих речовин: 2. Гідроліз крохмалю, деревини: (C6H10O5)n + nH2O → 2C2H5OH + 2СО2. Синтетичний метод: 3. Гідратація етилену. |
|
Застосування |
1. Як розчинник. 2. Сировина в оргсинтезi – виробництво деяких барвникiв, фотореактивiв, формальдегіду, пластмас, фармацевтичних препаратiв. |
1. Як розчинник. 2. Як паливо. 3. У парфумернiй промисловостi. 4. У харчовiй промисловостi. 5. Сировина в оргсинтезi: виробництво діетилового естеру, каучуку, пороху, барвників, пластмас, оцтової кислоти. |
Підсумок:
- Спирти – це сполуки в яких радикал CnH2n+1 сполучений з функціональною групою OH.
- Гідроксильна група зумовлює хімічні властивості спиртів.
- Метанол та етанол використовуються як розчинники та сировина в органічному синтезі.
?
- Які сполуки називаються спиртами?
- Що таке функціональна група?
- Які спирти називаються одноатомними?
- Чому метиловий спирт, що має легкі молекули є рідиною, а не газом?
- Назвіть галузі застосування спиртів.
Для допитливих
♦ Розрізнити метиловий й етиловий спирти можливо за допомогою йодоформної проби. Якщо до 1 мл спирту додати декілька крапель йодної настоянки, а потім водний розчин лугу, то випадання жовтого осаду засвідчить про те, що це – етиловий спирт. Наявність домішок метанолу в етиловому спирті за допомогою цієї проби встановити неможливо.
Для тих. хто хоче знати більше
Добування спиртів
1. У промисловості спирти добувають, діючи на галогенопохідні вуглеводнів розчином лугів або їх гідролізом. Реакція відбувається за схемою:
|
CnH2n+1CI + NaOH (AgOH) → CnH2n+1OH + NaCI (AgCI) |
Наприклад: C2H5CI (хлоретан) + NaOH → C2H5OH (етанол) + NaCI;
C2H5CI + H2 O → C2H5OH + HCI – гідроліз хлоретану.
2. Відновленням альдегідів. Реакція відбувається за схемою:
|
RCHO +H2 → ROH |
Наприклад: CH3CHO (етаналь) + H2 → CH3–CH2OH (етанол)
3. Гідроліз естерів. Реакція відбувається за схемою:
|
RCOOR1 +H2O→ RCOOH +R1OH |
Наприклад: CH3COOC2H5 (етилацетат) + H2O → CH3COOH (оцтова кислота) + C2H5OH (етанол)



















4 коментарі
Пропер
В таблиці номер 13, там де рядок про ЗАСТОСУВАННЯ є помилка. Колонка про метанол і замість фармацевтичних, написано фармацевтичнвх
Ximiya
дякуємо, виправили
Юлія
Хто автор книжки?
Ximiya
Про авора