Ковалентний зв’язок буває неполярним і полярним.
Ковалентний неполярний зв’язок
Цей зв’язок виникає між атомами елементів з однаковою електронегативністю. Найпростішим прикладом утворення ковалентного неполярного зв’язку є утворення молекули водню. Між атомами Гідрогену в молекулі утворюється електронна пара, яка стає спільною для обох атомів.
Розглянемо механізм утворення ковалентного неполярного зв’язку в молекулі фтору (F2). Атом Флуору знаходиться у II періоді, головній підгрупі VII групи, порядковий номер 9. Отже, його 9 електронів розміщуються на двох енергетичних рівнях. На зовнішньому рівні знаходиться 7 електронів, з яких 6 спарені і один неспарений (8 – 7 = 1).
![]()
Під час зближення двох атомів Флуору відбувається перекривання електронних хмар їхніх неспарених електронів з утворенням спільної електронної пари.
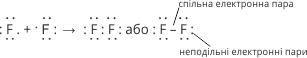
Умовно спільну електронну пару, або ковалентний зв’язок, часто позначають рискою. Крапкою позначають електронні пари, які не приймають участі в утворенні спільних пар. Такі електронні пари називають неподільними.
В даному випадку зовнішній електронний шар кожного атома завершується до октету.
![]()
Спільна електронна пара не зміщена, а знаходиться на рівній віддалі між ядрами атомів.
Утворення хімічного зв’язку між атомами в молекулах кисню і азоту також приводить до утворення спільних електронних пар, розміщених симетрично відносно ядер атомів і утворення у кожного з атомів восьмиелектронної конфігурації зовнішнього енергетичного рівня. Умовно це можна зобразити так:
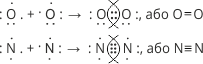
В молекулах водню і фтору атоми зв’язані за допомогою однієї спільної пари. Такий зв’язок називають одинарним. Зв’язок атомів у молекулі кисню здійснюється за допомогою двох спільних електронних пар – подвійний зв’язок. В молекулі азоту атоми зв’язані трьома спільними парами – потрійний зв’язок.
Ковалентний полярний зв’язок
Цей зв’язок виникає між неметалічними елементами з різною електронегативністю (різними неметалічними елементами). Найпростішим прикладом ковалентного полярного зв’язку може служити молекула гідроген флуориду HF. У атома Гідрогену на зовнішньому енергетичному рівні міститься один неспарений електрон; рівень незавершений. У атома Флуору на зовнішньому енергетичному рівні знаходиться сім електронів, шість з яких спарені і один неспарений. При взаємодії цих атомів виникає спільна електронна пара. Оскільки електронегативність Флуору більша, то спільна пара електронів буде зміщена до цього атома. Вважають, що атом, до якого зміщена електронна пара набуває деякого негативного заряду, а атом, від якого зміщена спільна електронна пара – деякого позитивного заряду.
Схематично утворення ковалентного полярного зв’язку в молекулі HF можна зобразити так:
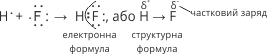
Схеми утворення молекул води (H2O), амоніаку (NH3), метану (CH4) можна зобразити так:
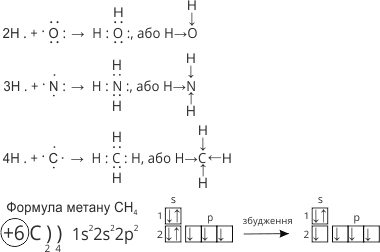
При взаємодії атома Гідрогену з Карбоном, атом Карбону переходить у «збуджений» стан. В результаті збудження два спарені s-електрони другого енергетичного рівня стають неспареними.
Ступінь зміщення спільної електронної пари залежить від природи неметалічних елементів. Чим яскравіше виражені неметалічні властивості елемента, тим більше відбувається зміщення спільної електронної пари в його бік. Так в ряду водневих сполук, які ми розглянули: HF, H2O, NH3, CH4, найбільше зміщення електронної пари у H → F і найменше – у CH4.
- У формулах бінарних сполук символ більш електронегативного елемента ставиться на другому місці (виняток: NH3, PH3).
- При взаємодії неметалічних елементів, які належать до однієї групи, електронна пара зміщується від елемента з більшим до елемента з меншим порядковим номером (знизу вгору).
- При взаємодії неметалічних елементів, які належать до одного періоду, електрони зміщуються від елемента з меншим до елемента з більшим порядковим номером (зліва направо).
Ковалентний зв’язок виникає внаслідок утворення однієї, двох або більше спільних електронних пар за рахунок неспарених електронів атома. Зв’язок між атомами за допомогою однієї спільної електронної пари називають простим, двох пар – подвійним, трьох пар – потрійним.
|
Тип зв’язку |
Представ-ники |
Частинки, за допомогою яких утворюється зв’язок |
Суть утворення хімічного зв’язку |
Сили, що утримують частинки в сполуці |
|
|
Йонний |
NaCI, K2O |
Йони |
Електрони переходять від металічного елемента до неметалічного |
Електро-статичні сили притягання між різнойменно зарядженими йонами |
|
|
Кова-лентний |
Непо-лярний |
F2, O2, N2 |
Електронні пари |
Спарювання електронів |
Електро-статичні сили притягання між електронними парами і позитивно зарядженими ядрами атомів обох елементів |
|
Полярний |
H2O, NH3, CO2 |
Спарювання електронів і зміщення електронної пари до більш електро-негативного елемента |
|||


















