Майже всі елементи утворюють оксиди. Виходячи з валентності Оксигену(ІІ) та валентності елементів, склад оксидів можна виразити такими формулами.
Загальні формули оксидів
|
Валентність елемента / № групи |
I |
II |
III |
IV |
V |
VI |
VII |
|
Формула оксиду |
Me2O |
MeO |
Me2O3 |
EO2 |
E2O5 |
EO3 |
E2O7 |
|
Приклад |
Na2O K2O |
ZnO BaO |
Al2O3 |
CO2 SiO2 |
N2O5 P2O5 |
SO3 |
Cl2O7 |
Назва оксидів
|
При сталій валентності елемента |
При змінній валентності елемента |
Тривіальні назви |
|
Якщо елемент має сталу валентність, то він утворює один оксид. Назва оксиду складається з назви елемента і слова «оксид». Наприклад: Na2O – натрій оксид, ZnO – цинк оксид. |
Якщо елемент має змінну валентність, то він може утворювати кілька оксидів. Тоді в назві таких оксидів вказується валентність елемента: а) SO2 – сульфур(IV) оксид; |
Назви деяких оксидів, які зустрічаються у повсякденному житті: CаO – негашене вапно; |
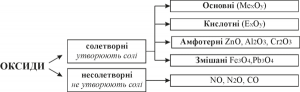
Класифікація оксидів
де Ме – умовно металічний елемент, Е – умовно неметалічний елемент.
Оксиди, що взаємодіють з кислотами, утворюючи сіль і воду, називають оснóвними. Цю назву їм дали тому, що кожному оснóвному оксидові відповідає основа. Оснóвні оксиди утворюються тільки металічними елементами. Гідратами цих оксидів є основи:
MexOy → Me(OH)n;
![]() ; K2O → KOH; Al2O3 → Al(OH)3.
; K2O → KOH; Al2O3 → Al(OH)3.
Оксиди, які взаємодіють з основами, утворюючи сіль і воду, називають кислотними.
Називають їх так тому, що кожному кислотному оксидові відповідає кислота: ExOy → HnR, де R — кислотний залишок.
Приклад: SO2 → H2SO3; P2O5 → H3PO4; As2О3 → H3AsO3; SO3 → H2SO4; SiO2 → H2SiO3; Cl2О5 → HClO3; CO2 → H2CO3; В2О3 → H3ВO3; N2O5 → HNO3.
Кислотні оксиди утворюються неметалічними і деякими металічними елементами, наприклад: елементи Хром і Манган, які мають змінну валентність, утворюють основні і кислотні оксиди:
CrO → Cr(OH)2; CrO3 → H2CrO4; MnO → Mn(OH)2; Mn2O7 → HMnO4.
Солетворними називають такі оксиди, які в результаті певних хімічних реакцій утворюють солі. Несолетворні оксиди солей не утворюють.
Амфотерними називають оксиди металічних елементів, що утворюють солі як при взаємодії з кислотами (кислотними оксидами), так і з основами (основними оксидами), тобто проявляють кислотний або основний характер залежно від умов.
Деякі бінарні оксигеновмісні сполуки відносять до змішаних або подвійних оксидів. Графічні формули таких сполук показують, що атоми металічного елемента мають різну валентність. Вивчення властивостей змішаних оксидів показує, що їх також можна розглядати як солі певних кислот. Наприклад, сполука Fe3O4 є продуктом взаємодії основного оксиду FeO, з амфотерним Fe2O3. При цьому утворюється сіль ферит феруму Fe(FeO2)2. Графічно цю сіль можна подати так:
O = Fe+3 – O – Fe+2 – O – Fe+3 = O
Поширення у природі. Застосування
Мабуть, важко переоцінити значення оксидів. Оксиди доволі поширені у природі завдяки хімічній активності Оксигену. В атмосферному повітрі містяться такі його сполуки як вуглекислий газ CO2, водяна пара, оксиди Нітрогену та Сульфуру.
Вода – найпоширеніший оксид на Землі. Вода вкриває близько 71% земної поверхні. Такий важливий оксид, як вода, необхідний для нормальної життєдіяльності всіх організмів. Він є розчинником значної кількості поживних речовин. Воду називають живою кров’ю Землі. Масова частка води в організмі людини складає близько 65%-80%.
Вода незвичайна тим, що вона, охолоджуючись до температури +4°С, стискується, а після подальшого зниження температури – розширюється. На властивості води впливає кремній і сполуки Силіцію. Якщо 10 частин води змішати з 1 частиною силікатної кислоти, то утворюється «суха вода». Інші кремнієві сполуки роблять воду такою густою, що вона стає подібна до ґуми, і її можна різати ножем.
Тверду оболонку Землі утворюють сполуки, що містять оксиди. Вони входять до складу гірських порід, грунтів, мінералів.
Силіцій оксид (SiO2) є в складі піску, глини, кварцу. SiO2 відомий як пісок. Він утворюється у процесі вивітрювання гірських порід. Чистий, майже білий пісок називають кварцом. Силіцій оксид трапляється у вигляді кристалів гірського кришталю. Забарвлений кришталь утворює напівкоштовне каміння: фіалковий аметист, димчастий топаз, барвисту яшму та опал. Трапляється силіцій оксид у вигляді кременю, з якого ще в сиву давнину виготовляли перші знаряддя праці.
Алюміній оксид (Al2O3) входить до складу глини і різних гірських порід. Його прозорі кристали з домішками інших речовин утворюють коштовне каміння: сині сапфіри, червоні рубіни. Непрозорий корунд використовують як наждак для виготовлення шліфувальних кругів, брусків для полірування.
Значно поширені оксиди феруму, які входять до складу залізних руд, наприклад, – Fe3O4 (магнітний залізняк), Fe2O3 (червоний залізняк). Fe2O3 – тверда кристалічна речовина червоно-коричневого кольору, використовується для виплавляння чавуну, у лакофарбовій промисловості, виробництві лінолеуму.
CaO – біла тугоплавка речовина, відома як палене, або негашене, вапно. Без цього оксиду не обходиться жодне будівництво. В реакції з водою він утворює вапняний розчин, а після додавання піску – будівельний розчин.
CO2 – вуглекислий газ, необхідний для процесу фотосинтезу зеленим рослинам. У природі він утворюється під час дихання, горіння, гниття органічних решток. Його використовують у вигляді «сухого льоду» для охолодження продуктів харчування тощо.
ZnO і TiO використовують для виготовлення білила, Cr2O3 – зеленої фарби, MnO2 – фіолетової, FeO • CaO • Al2O3 – чорної фарби.