Фізичні властивості
Чиста нітратна (азотна) кислота – безбарвна рідина з різким подразнюючим запахом, дуже гігроскопічна, летка, важча за воду. Безводна нітратна кислота «димить» на повітрі внаслідок утворення туману, який складається з крапельок розчину кислоти. Кислота змішується з водою в будь-яких співвідношеннях. Водний розчин нітратної кислоти з масовою часткою кислоти 96-98 % називається концентрованою кислотою. Концентрована нітратна кислота забарвлена в жовтий колір. Такого кольору надає їй нітроген(IV) оксид NO2, який утворюється внаслідок часткового розкладу нітратної кислоти і розчиняється в ній. На практиці використовують водний розчин кислоти з масовою часткою 63-65% НNO3, таку кислоту також називають концентрованою.
Хімічні властивості
Нітратна кислота належить до сильних одноосновних кислот. У водному розчині вона майже повністю дисоціює. Кислота проявляє загальні властивості кислот: взаємодіє з основними і амфотерними оксидами, основами та солями.
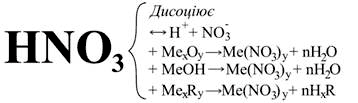
Наприклад:
2HNO3 + CaO = Ca(NO3)2 + H2O
HNO3 + KOH = KNO3 + H2O
2HNO3 + Na2S = 2NaNO3 + H2S↑
Специфічні властивості
1. Нітратна кислота – сильний окисник, тому її реакції з металами значно відрізняються від реакцій металів з хлоридною та розбавленою сульфатною кислотами: при дії нітратної кислоти на метали водень ніколи не виділяється, він окиснюється з утворенням води. Взаємодія з металами супроводжується відновленням Нітрогену нітратної кислоти до різного ступеня окиснення. Продукти відновлення Нітрогену в нітратній кислоті залежать від активності металу і концентрації кислоти.
Взаємодія нітратної кислоти з металами
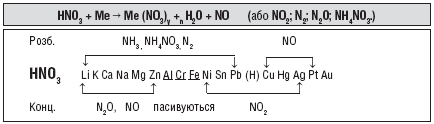
Концентрована нітратна кислота не діє на Al, Cr, Fe, Pt та Au при нормальних умовах. Розведена кислота не взаємодіє з Pt, Au.
Наприклад, внаслідок взаємодії розбавленої нітратної кислоти з лужними та лужноземельними металами може утворюватися NH4NO3 або N2O:
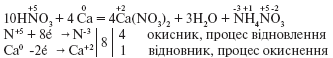
Внаслідок взаємодії концентрованої нітратної кислоти з лужними та лужноземельними металами може утворюватися N2O, наприклад:
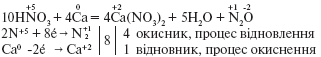
2. Під дією світла та під час нагрівання кислота розкладається на воду, нітроген(IV) оксид і кисень: 4 HNO3 = 4NO2 + 2H2O + O2.
Тліюча скіпка, скипидар і тирса в концентрованій кислоті займається. З білками нітратна кислота утворює речовини яскраво-жовтого кольору тому, при потраплянні на шкіру викликає утворення жовтих плям.
3. Нітратна кислота взаємодіє з неметалами, наприклад:
Р + 5HNO3(конц.) = НРО3 + 5NO2 + 2H2O
3Р + 5HNO3(розбавл.) + 2H2O = 3Н3РО4 + 5NO
Застосування нітратної кислоти
Нітратну кислоту використовують для виробництва барвників, фотоплівки, лікарських і вибухових речовин, пластичних мас, азотних добрив, замість рідкого кисню як окисник у ракетних двигунах, у текстильній промисловості, металургії золота і срібла.


















