Чтобы глубже понять природу растворов, сравним растворение с испарением. При испарении, так же как и при растворении, происходит дробление вещества на молекулы, то есть нарушается связь между испаряемыми частицами вещества. На это уходит энергия, поэтому испарение всегда сопровождается охлаждением: испарение происходит за счет кинетической энергии теплового движения молекул.
Не происходит ли подобное при растворении? Проверить это можно на опыте. С заметным даже на ощупь охлаждением растворяется в воде много солей, в том числе поваренная соль. Растворение в воде некоторых солей сопровождается очень большим понижением температуры. Так, если растворять в воде аммоний хлорида в тонкостенном стакане, который стоит на мокрой дощечке, то поглощается столько тепла, что стакан примерзает к дощечке.
Рис. 16. Растворимость NH4Cl в воде.
Однако в других случаях при растворении веществ тепло не поглощается, а наоборот выделяется. Так, при растворении в воде сульфатной кислоты выделяется столько тепла, что вода может закипеть.
Рис. 17. Растворимость H2SO4 в воде.
Таким образом, в одних случаях тепло при растворении выделяется, в других – впитывается. Это показывает, что растворение не сводится только к распределению частиц одного вещества между частицами (молекулами) другого, а сопровождается химическим взаимодействием частиц растворяемого вещества с частицами (молекулами) растворителя. Это взаимодействие в одних случаях оказывается в большей степени, в других – меньше.
Процесс растворения – это взаимодействие частиц растворенного вещества с молекулами растворителя, сопровождающегося выделением или поглощением теплоты.
Голландский химик Я. Х. Вант-Гофф и немецкий химик В. Оствальд доказали диффузию газов. Шведский ученый С.А. Аррениус (1859-1927) доказал наличие физического процесса диффузии в растворах. Подтверждением этого является равномерная окраска растворов при растворении окрашенных веществ.
Рис.18. Диффузия купрум (ІІ) сульфата.
Д.И. Менделеев создал химическую теорию растворов. Согласно этой теории при растворении образуются сольваты – неустойчивые химические соединения растворенного вещества с растворителем (в случае водных растворов – гидраты). Особенно склонны к гидратации ионы. Ионы подсоединяют полярные молекулы воды, в результате образуются гидратированные ионы. Многие из таких гидратированных ионов непрочны и легко разлагаются.
Если, например, поваренную соль поместить в воду, можно заметить, как масса твердого вещества постепенно уменьшается. В процессе растворения молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связи между ионами в соли ослабляется и кристаллическая решетка разрушается. В растворе образуются временные соединения гидрат-ионов Натрия и гидрат-ионов Хлора.
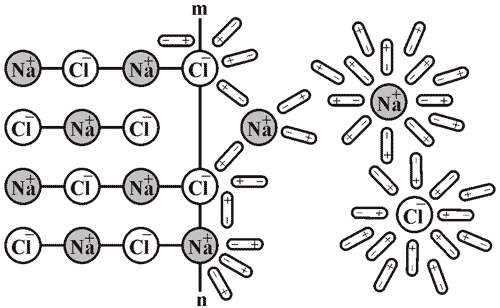
Рис. 19. Схема растворения натрия хлорида в воде (m-n – поверхность кристалла).
А – распад на ионы (ионизация). Теплота поглощается разрушением связей.
Б – гидратация с образованием гидрат-ионов. При образовании гидратов выделяется тепло.
Ионизация – это процесс распада вещества на ионы под действием полярного растворителя.
Гидратация – это процесс образования гидрат-ионов.
Гидрат-ион – это ион окруженный диполями воды.

И.А. Каблуков (1857 – 1942). Советский учёный, академик. Ввел представление о гидратации ионов, основал физическую и химическую теорию растворов.
Почему при растворении веществ в одних случаях наблюдается разогрев, а в других – охлаждение? Это объясняется тем, что при связывании частиц растворяемого вещества с молекулами растворителя выделяется энергия (при образовании связей в гидрат-ионах), а при разрушении связей между ионами кристалла соли, теплота поглощается. Если теплоты выделяется больше, чем тратится на разрыв связей между частицами растворяемого вещества, то растворение сопровождается нагреванием. Если теплоты выделяется меньше при образовании гидрат-ионов, необходимая энергия впитывается извне и происходит охлаждение. По этому признаку процесс растворения следует отнести к физическим явлениям. Как вы знаете, выделение теплоты – признак химической реакции. Следовательно, при растворении осуществляются и химические реакции. К примеру, молекулы сульфатной кислоты реагируют с молекулами воды и образуются соединения состава: Н2SO4 • H2О (моногидрат сульфатной кислоты) и Н2SO4 • 2H2О (дигидрат сульфатной кислоты).
Взаимодействие молекул сульфатной кислоты с молекулами воды относят к реакциям гидратации, а образующиеся при этом вещества называют гидратами.
В зависимости от соотношения тепловых эффектов процесс растворения вещества может быть экзо- или эндотермическим. Если:
|
Q ионизации = Q гидратации Q ионизации < Q гидратации Q ионизаци > Q гидратации |
t° раствора не изменится. раствор нагревается (экзотермический процесс). раствор охлаждается (эндотермический процесс). |
Итак, процесс растворения – это физико-химический процесс.
Есть две точки зрения на природу растворов: физическая и химическая. Согласно первой, растворы рассматривались как механические смеси, а согласно второй – как неустойчивые химические соединения молекул растворенного вещества и растворителя. Последнюю точку зрения высказал в 1887 г. Д.И. Менделеевым.
Понятие о кристаллогидратах
Количество молекул воды в формульной единице кристаллогидрата не связано с валентностью элементов
Через некоторое время после растворения гидрат-ионы разрушаются, однако некоторые ионы так крепко удерживают возле себя диполи воды, что в таком состоянии могут сохраняться даже после нагревания, образуются кристаллогидраты.
Кристаллические вещества, в состав которых входят определенное число молекул воды, называют кристаллогидратами.
Вода, входящая в состав кристаллов, называется кристаллизационной водой.
В том, что между частицами растворенного вещества и молекулами раствора происходит взаимодействие, убедимся на опыте. Если в пробирку белого порошка купрум (II) сульфата долить немного воды, наблюдается сильный нагрев раствора, а порошок из белого становится голубым.
Если этот раствор упарить досуха, то вместо белого порошка образуется в виде кристаллов другое вещество – медный купорос. Химический анализ показывает, что в медном купоросе каждая молекула купрума сульфата связана с пятью молекулами воды, поэтому состав медного купороса изображается формулой CuSO4 • 5H2O.
CuSO4 + 5H2O → CuSO4 • 5H2О
При прокаливании медного купороса вода из него испаряется и вновь образуется купрум (II) сульфат:
CuSO4 • 5H2O → CuSO4 + 5H2O. Количество молекул воды в формульной единице кристаллогидрата не связано с валентностью элементов.

Рис 20. Выделение кристаллизационной воды при нагревании медного купороса.
|
Примеры некоторых кристаллогидратов |
|
|
CuSO4 • 5H2O – купрум сульфат. пентагидрат; медный купорос |
Na2СO3 • 10H2O – натрий карбонат, декагидрат |
|
FeSO4 • 7H2O – ферум сульфат, гептагидрат; железный купорос |
MgSO4 • 6H2O – магний сульфат, гексагидрат; горькая соль |
|
CaSO4 • 2H2O – гипс |
BaCl2 • 2H2O – барий хлорид, дигидрат |
|
Na2SO4 • 10H2O – глауберова соль |
SnCl2 • 2H2O – станум (II) хлорид, дигидрат |
|
CuCl2 • 2H2O – купрум (II) хлорид, дигидрат |
NiSO4 • 7H2O – никель сульфат, гептагидрат |
|
Ca(NO3)2 • 4H2O – кальций нитрат, тетрагидрат |
FeCl3 • 6H2O – ферум (III) хлорид, гексагидрат |
Итог:
- Для ускорения процесса растворения увеличивают площадь соприкосновения между растворителем и растворенным веществом. Для этого растворы измельчают и перемешивают.
- Процесс растворения можно рассматривать как совокупность таких физико-химических процессов:
|
Химический процесс |
|
|
Физический процесс |
|
?
- Как и почему при растворении веществ в воде может изменяться температура растворов?
- Как вы понимаете процесс гидратации?
- Что такое кристаллогидраты?
- Какой химический процесс происходит при растворении веществ в воде?
Экспериментируем
Химический «хамелеон»
Поместите в пробирку сухую соль кобальта хлорида и добавьте небольшое количество безводного ацетона. Содержимое перемешайте. Соль и слой ацетона приобретет синий цвет. Добавить воду. Раствор приобретет розовый цвет. Суть опыта в том, что ацетон поглощает воду из кристаллогидрата, кристаллогидрат разрушается. Безводная соль, которая при этом образуется, имеет синюю окраску. Если добавить воду, происходит обратный процесс – образование кристаллогидрата:
CoCI2 • 6H2O (розовый кристаллогидрат) ⇄ CoCI2 (синяя безводная соль) + 6H2O
Этот опыт показывает, что кристаллогидраты удерживают воду по-разному. К примеру, если добавить ацетон к медному купоросу, изменения цвета не произойдет потому что медный купорос более устойчив.

















