Физические свойства
Чистая азотная (нитратная) кислота – бесцветная жидкость с резким раздражающим запахом, очень гигроскопична, летучая, тяжелее воды. Безводная азотная кислота «дымит» на воздухе вследствие образования тумана, состоящего из капелек раствора кислоты. Кислота смешивается с водой в любых соотношениях. Водный раствор азотной кислоты с массовой долей кислоты 96-98% называется концентрированной кислотой. Концентрированная азотная кислота окрашена в желтый цвет. Такой цвет придает ей нитроген(IV) оксид NO2, который образуется в результате частичного разложения азотной кислоты и растворяется в ней. На практике используют водный раствор кислоты с массовой долей 63-65% НNO3, такую кислоту также называют концентрированной.
Химические свойства
Азотная кислота относится к сильным одноосновным кислотам. В водном растворе она почти полностью диссоциирует. Кислота проявляет общие свойства кислот: взаимодействует с основными и амфотерными оксидами, основаниями и солями.
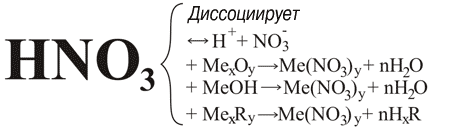
Например:
2HNO3 + CaO = Ca(NO3)2 + H2O
HNO3 + KOH = KNO3 + H2O
2HNO3 + Na2S = 2NaNO3 + H2S↑
Специфические свойства
1. Азотная кислота – сильный окислитель, поэтому ее реакции с металлами значительно отличаются от реакций металлов с хлоридной и разбавленной серной кислотами: при действии азотной кислоты на металлы водород никогда не выделяется, он окисляется с образованием воды. Взаимодействие с металлами сопровождается восстановлением Нитрогена азотной кислоты до различной степени окисления. Продукты восстановления Нитрогена в азотной кислоте зависят от активности металла и концентрации кислоты.
Взаимодействие азотной кислоты с металлами
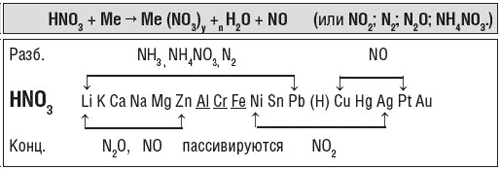
Концентрированная азотная кислота не действует на Al, Cr, Fe, Pt и Au при нормальных условиях. Разбавленная кислота не взаимодействует с Pt, Au.
Например, в результате взаимодействия разбавленной азотной кислоты с щелочными и щелочноземельными металлами может образовываться NH4NO3 или N2O:

В результате взаимодействия концентрированной азотной кислоты со щелочными и щелочноземельными металлами может образовываться N2O, например:
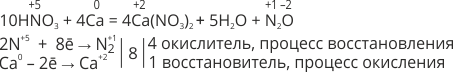
2. Под действием света и при нагревании кислота разлагается на воду, нитроген(IV) оксид и кислород: 4 HNO3 = 4NO2 + 2H2O + O2.
Тлеющая лучина, скипидар и опилки в концентрированной кислоте воспламеняется. С белками нитратная кислота образует вещества ярко-желтого цвета поэтому, при попадании на кожу вызывает образование желтых пятен.
3. Азотная кислота взаимодействует с неметаллами, например:
Р + 5HNO3(конц.) = НРО3 + 5NO2 + 2H2O
3Р + 5HNO3(разб.) + 2H2O = 3Н3РО4 + 5NO
Применение нитратной кислоты
Азотную кислоту используют для производства красителей, фотопленки, лекарственных и взрывчатых веществ, пластических масс, азотных удобрений, вместо жидкого кислорода как окислитель в ракетных двигателях, в текстильной промышленности, металлургии золота и серебра.

















