В органічній хімії застосовують молекулярні, емпіричні, структурні, напівструктурні та електронні формули. Молекулярна формула показує якісний і кількісний склад атомів в молекулі. Емпірична формула показує відносне число атомів кожного елемента в молекулі. Структурні та електронні формули відображають порядок з’єднання атомів у молекулі. В органічній хімії звичайно користуються напівструктурними формулами, оскільки атоми мають просторове розміщення у молекулі. Структурні формули – це мова органічної хімії.
Формули сполук:
| Назва сполуки | Молекулярна формула | Структурна формула | Напівструктурна формула | Електронна формула |
| Етилен | С2Н4 | |
CH2=CH2 | |
Кожна речовина має свою хімічну формулу. Однак, були виявлені речовини, які мали однакові хімічні формули, але проявляли різні властивості. Теорія будови пояснила причину існування таких сполук. У насичених вуглеводнів атоми Карбону можуть сполучатися послідовно в ланцюг, тому такі вуглеводні називають нерозгалуженими. Але для алканів, що містять чотири і більше атомів Карбону, можливі інші структури, які складаються з розгалужених ланцюгів атомів Карбону. Існують два бутани С4Н10, які відрізняються за фізичними властивостями: нормальний бутан: СН3–СН2–СН2–СН3, температура кипіння якого + 0,6ºС та бутан розгалуженої будови (ізобутан): ![]() , температура кипіння якого + 11,7ºС.
, температура кипіння якого + 11,7ºС.
Молекула пентану С5Н12 може існувати у вигляді трьох ізомерів: СН3-СН2-СН2-СН2-СН3 – нормальної будови (н-пентан), та два ізопентани, що мають розгалужений карбоновий скелет: ![]() та
та 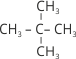 .
.
Отже, у сполук Карбону одна і таж молекулярна формула відповідає не одній, а декільком сполукам, які відрізняються за фізичними та хімічними властивостями.
Сполуки, що мають однаковий склад, але різну будову молекул, що спричиняє різні властивості, називають ізомерами (гр. isoc – «однаковий» і meros – «частина»), а явище існування таких сполук – ізомерією.
Наявність ізомерів зумовлює численність органічних сполук. Чим більше атомів Карбону містить органічна сполука, тим більше ізомерів вона утворює. Наприклад, для гексану характерні 5 ізомерів, гептану – 9, октану – 18, нонану – 35, декану – 75.
Ізомерія в органічній хімії дуже поширена. З нею зустрічаються при вивченні всіх класів органічних сполук. Ізомерію, зумовлену різною послідовністю сполучення атомів у молекулах, а також різним положенням кратних зв’язків у них, називають структурною ізомерією.
Структурна ізомерія
Структурні ізомери поділяють на групи:
а) сполуки, які відрізняються між собою будовою карбонового скелета. Прикладом можуть служити ізомери бутану. При наявності в молекулі органічної сполуки чотирьох атомів Карбону можлива ізомерія у результаті різного розміщення атомів Карбону. С4Н10 бутан існує у вигляді двох ізомерів;
б) ізомерія положення кратного зв’язку: СН3-СН=СН-СН3 бут-2-ен і СН2=СН-СН2-СН3 бут-1-ен;
в) ізомерія положення функціональної групи: СН3-СНОН-СН2-СН3 бутан-2-ол і СН2ОН-СН2-СН2-СН3 бутан-1-ол;
г) ізомерія складу вуглеводневого радикалу: C2H5-NH2 етамін (етиламін) та CH3-NH-CH3 диметиламін;
д) міжкласова ізомерія: алкени-циклоалкани, алкіни-алкадієни, одноатомні спирти-етери, альдегіди-кетони, одноосновні карбонові кислоти – естери. Наприклад, формулі С2Н6О відповідають дві різні за властивостями речовини: етиловий спирт С2Н5ОН, що відносять до класу спиртів та метоксиметан (диметиловий етер) СН3-О-СН3 із класу етерів.
Структурна ізомерія у насичених вуглеводнів пов’язана з ізомерією карбонового скелета.
Номенклатура алканів
Із зростанням числа атомів Карбону в молекулі зростає число можливих ізомерів. Тому недостатньо називати лише, наприклад, ізогексан, яких може бути п’ять для гексану. Назва ізомерів повинна бути складена так, щоб вона не лише вказувала на число атомів, які входять до складу речовини, але й давала уявлення про структуру його молекули, щоб можна було легко і точно написати її структурну формулу. З цією метою вчені розробили правила складання індивідуальних назв речовин – номенклатуру. В органічній хімії для найменування сполук існує кілька номенклатур: історична або тривіальна, раціональна, систематична (міжнародна, ІЮПАК, замісникова система назв органічних сполук ) номенклатура.
Історична номенклатура виникла в давнину, коли органічним сполукам присвоювали випадкові назви. Здебільшого ці назви вказували на походження речовин. Наприклад, мурашина, щавлева, яблучна, винна кислоти, деревний спирт та ін. Ця номенклатура не дає можливості називати ізомери.
Найбільш зручною є міжнародна номенклатура, у основу якої покладено назви насичених вуглеводнів. Для того, щоб називати ізомери за цією номенклатурою нам спершу необхідно познайомитися з радикалами і замісниками.
При відриві атома Гідрогену від молекул алканів утворюються одновалентні частинки, які називають вільними радикалами.
Назви одновалентних радикалів походять від назв відповідних вуглеводнів із заміною закінчення –ан на –ил, -іл. Одновалентний радикал виражається загальною формулою СnН2n+1–.
–СН3 метил, –С4Н10 бутил, –С2Н5 етил, –С6Н5 феніл, –С3Н7 пропіл, –СН=СН2 вініл та ін.
Ознайомимося з номенклатурою насичених вуглеводнів. Перші чотири члени ряду насичених вуглеводнів отримали тривіальну назву: СН4 – метан, С2Н6 – етан, С3Н8 – пропан, С4Н10 – бутан. Починаючи з пентану ця номенклатура передбачає виділення головного ланцюга, у якому відбулося заміщення атомів Гідрогену на замісники, функціональні групи, атоми інших елементів або групи атомів, які позначаються за допомогою префіксів та суфіксів.
Назви насичених вуглеводнів розгалуженої будови складають за такими правилами:
| 1. У структурній формулі алкану розгалуженої будови вибирають найдовший ланцюг атомів Карбону і нумерують атоми Карбону арабськими цифрами з того кінця, до якого ближче стоїть замісник (радикал). Якщо різні замісники перебувають на однаковій відстані від обох кінців ланцюга, то нумерацію здійснюють з того кінця, біля якого перебуває замісник, який називають першим за алфавітом. Якщо однакові замісники перебувають на однаковій відстані від обох кінців ланцюга, то нумерацію здійснюють з того кінця, де більше відгалужень. 2. Визначають назву кожного замісника. Назви замісників розміщують за алфавітом. Перед назвою кожного замісника через дефіс указують номер атома Карбону з яким сполучений замісник і його назву: 3-етил-5-метил… Якщо біля одного і того самого атома Карбону є два однакових замісники, то номер атома Карбону повторюють двічі: 2,2-… 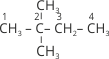 За наявності кількох однакових замісників зазначають їх кількість, додаючи до назви замісника префікс ((2) ди- або ді-, (3) три-, (4) тетра-, (5) пента-, тощо), а перед ним указують номери відповідних атомів Карбону, розподілені комою, а від словесних частин назви відокремлюються дефісом: 3-етил-2,3-диметил… 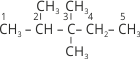 3. В кінці називають алкан за кількістю атомів Карбону в пронумерованому карбоновому ланцюгу: 3-етил-2,3-диметилпентан. 3. В кінці називають алкан за кількістю атомів Карбону в пронумерованому карбоновому ланцюгу: 3-етил-2,3-диметилпентан. |
Важливо навчитися зіставляти між собою структури і бачити серед них принципово різні і тотожні.
У молекулі навколо простих карбон-карбонових зв’язків за нормальних умов можливе вільне обертання. Внаслідок цього молекула може набувати різних форм:
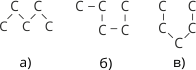
Рис. 4. Різні просторові форми карбонових ланцюгів н-пентану
Слід пам’ятати, якої б форми не набув карбоновий ланцюг, послідовність сполучення атомів в усіх випадках залишається тією самою, що й виражається структурною формулою.
Часто доводиться проводити зворотну процедуру – за назвою алкану написати його структурну формулу. Наприклад, нам необхідно написати структурну формулу 3-етил-2,4,4-триметилгексану.
1. Записуємо ланцюг із шести атомів Карбону і нумеруємо їх: ![]() .
.
2. До третього атома Карбону приєднуємо радикал етил, до другого один, а до четвертого два радикали метилу: 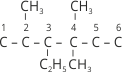 .
.
3. Дописуємо до атомів Карбону головного ланцюга необхідну кількість атомів Гідрогену й отримуємо формулу алкану: 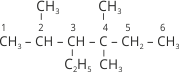 .
.
Лабораторний дослід 1. Виготовлення моделей молекул парафінів
Моделі молекул можна зібрати з деталей стандартного заводського ґатунку або виготовити з пластиліну й сірників.
Модель молекули метану
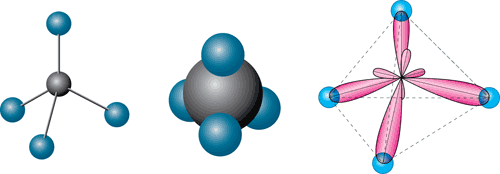
З пластиліну одного кольору виготовте чотири кульки однакового розміру. З пластиліну іншого кольору виготовте кульку, діаметр якої в 1,5 рази більший від діаметра попередніх. На поверхні більшої кульки («атом Карбону») приблизно на однакових відстанях зробіть чотири помітки. У цих місцях вставте стержні (сірники), до кінців яких приєднайте маленькі кульки («атоми Гідрогену»). Ви отримали кулестержневу модель молекули метану.
Виготуйте напівсферичну модель метану. Для цього зробіть на атомі Карбону чотири зрізи під тетраедричними кутами. Зробіть по одному зрізу на чотирьох атомах Гідрогену. Прикладіть зрізами атоми Гідрогену до зрізів атома Карбону.
Модель молекули пропану
З пластиліну одного кольору виготуйте вісім кульок однакового розміру («атоми Гідрогену»). З пластиліну іншого кольору виготуйте три кульки, діаметр яких в 1,5 раза більший від діаметра попередніх. Три кульки більшого діаметра («атоми Карбону») за допомогою сірників (хімічні зв’язки) з’єднайте послідовно між собою під кутом 1090. Відповідно до структурної формули пропану до більших кульок за допомогою стержнів (сірників) приєднайте вісім менших кульок, які умовно зображають атоми Гідрогену.
Модель молекули хлорпропану
З одного стержня моделі молекули пропану зніміть одну маленьку кульку («атом Гідрогену»). Замість неї прикріпіть кульку іншого кольору («атом Хлору»), діаметр якої приблизно в 2 рази більший від діаметра меншої кульки.
Запитання для висновків
1. Чому для виготовлення моделей потрібні кульки різних розмірів?
2. Яка будова моделі молекули метану?
3. Якої форми набув карбоновий ланцюг пропану?


















