Оксид – сполука утворена двома хімічними елементами, одним із яких є Оксиген.
Майже всі елементи утворюють оксиди. Виходячи з валентності Оксигену(ІІ) та валентності елементів, склад оксидів можна виразити такими формулами.
(більше…)
Оксиди можуть перебувати у різних агрегатних станах:
а) тверді – ZnO, Al2O3, Fe2O3, SiO2, P2O3, N2O5 тощо;
б) рідкі – H2O, SO3, Cl2O7, Mn2O7 тощо;
в) газуваті – CO2, SO2, NO, NO2 тощо.
Основи – це сполуки, до складу яких входять атом металічного елемента й одна або кілька гідроксильних груп OH (залежно від валентності металу).
Основи – сполуки, які містять катіони металічних елементів і гідроксид- аніони ОН–
Кислоти – це сполуки, до складу яких входить один або кілька атомів Гідрогену (здатних заміщуватися на атоми металічних елементів) та кислотний залишок.
Загальна формула кислот – HnR, де R – кислотний залишок.
Кислотний залишок – це атом чи група атомів, що входить до складу молекули кислоти.
Для складання пропорцій беремо такі відношення: m/m; V/V; υ/υ, якщо: m (г), то V (л); m (кг), то V (м3); m (мг), то V (мл).
Крім кислотних і оснόвних оксидів, існують такі, які можуть реагувати і з кислотами, і з лугами.
Оксиди, здатні виявляти і оснóвні, і кислотні властивості, називають амфотерними.
1. Взаємодія солей з металами
Кожний метал у ряді напруг здатний витісняти всі метали, що стоять справа від нього, з розчинів їх солей з утворенням нової солі та іншого металу. Якщо в пробірку з розчином CuCl2 опустити залізний цвях, то через деякий час він вкриється шаром міді. Відбувається реакція заміщення: CuCl2 + Fe = FeCl2 + Cu.
Зміст – 8 клас
- Тема 1. Періодичний закон і періодична система елементів Д. І. Менделеєва. Будова атома
- 1.1. Короткі історичні відомості про спроби класифікації хімічних елементів
- 1.2. Поняття про природні групи елементів
- 1.3. Періодичний закон і періодична система елементів Д.І. Менделєєва
- 1.4. Структура періодичної системи хімічних елементів
- 1.5. Будова атома
- 1.6. Ізотопи
- 1.7. Будова електронних оболонок атомів
- 1.8. Поняття про радіус атома
- 1.9. Фізичний зміст періодичного закону
- 1.10. Періодична система хімічних елементів з позиції теорії будови атома
- 1.11. Характеристика хімічних елементів за положенням в періодичній системі та будовою атома
- 1.12. Значення періодичного закону
- Контроль навчальних досягнень за темою «Періодичний закон і періодична система елементів Д. І. Менделеєва. Будова атома»
- Приклади розв’язування типових задач
- Тема 2. Хімічний зв’язок і будова речовин
- Тема 3. Кількість речовини. Розрахунки за хімічними формулами
- 3.1. Кількість речовини. Моль – одиниця кількості речовини. Число Авогадро
- 3.2. Молярна маса
- 3.3. Обчислення кількості речовини за відомою масою та за числом атомів
- 3.4. Обчислення за хімічною формулою маси речовини
- 3.5. Порівняння мас атомів різних елементів
- 3.6. Закон Авогадро. Молярний об’єм газів
- 3.7. Відносна густина газів
- 3.8. Визначення молярної маси газів за відносною густиною
- Контроль навчальних досягнень за темою «Кількість речовини. Моль»
- Тема 4. Основні класи неорганічних сполук
- 4.1. Оксиди
- 4.2. Фізичні та хімічні властивості оксидів
- 4.3. Основи
- 4.4. Хімічні властивості основ
- 4.5. Кислоти
- 4.6. Хімічні властивості кислот та способи їх добування
- 4.7. Розрахунки за хімічними рівняннями
- 4.8. Амфотерні оксиди та гідроксиди
- 4.9. Солі
- 4.10. Хімічні властивості солей
- 4.11. Найважливіші способи добування солей
- 4.12. Генетичний зв’язок між класами неорганічних сполук
- 4.13. Узагальнення знань за темою: «Основні класи неорганічних сполук»





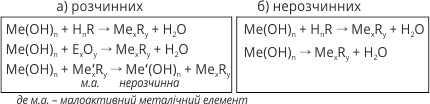


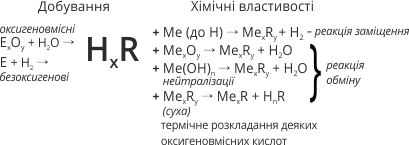














Останні коментарі
JESSESJUXXX у: 4.7. Розрахунки за хімічними рівняннями
У першій задачі помилка, у заліза не 2 моль, а 1 моль, але кінцева відповідь вір ...
Наташа у: §21. Відношення об’ємів газів у хімічних реакціях
Пожалуйста срочно ответ на номер 249 и 525 в 21 параграфе ...
Ximiya у: §6. Масова частка розчиненої речовини
Дякуємо, виправили ...
Ximiya у: §24. Поняття про оксиди. Умови виникнення й припинення горіння
http://www.chemistry.in.ua/about ...
Ximiya у: §30. Метанол і етанол як представники насичених одноатомних спиртів
дякуємо, виправили ...