Прості речовини елементів І групи головної підгрупи називаються лужними металами. Лужними вони називаються тому, що їх гідроксиди є сильними лугами. До цих елементів належать Літій, Натрій, Калій, Рубідій, Цезій і Францій.
Атоми лужних металів, маючи один електрон на зовнішньому енергетичному рівні (s1), легко віддають його при хімічних реакціях. Віддаючи електрон, нейтральні атоми перетворюються в однозарядні позитивні йони:
![]() або Na0 – 1ē → Na+
або Na0 – 1ē → Na+
У сполуках ці елементи проявляють ступінь окиснення +1 і утворюють тільки йонні сполуки. У вільному вигляді атоми електронейтральні (ступінь окиснення нуль). Валентність І. В межах кожного періоду це найбільш активні металічні елементи і найсильніші відновники. Із зростанням порядкового номера збільшується радіус атомів. Зовнішній або валентний електрон усе більше віддаляється від ядра і металічні властивості зростають Li → Na → K → Rb → Fr.
Знаходження в природі
Внаслідок хімічної активності лужні метали зустрічаються в природі у вигляді сполук:
| Сполуки Натрію Вміст Натрію в земній корі становить 2,64% |
Сполуки Калію Вміст Калію в земній корі становить 2,6% |
| NaCl – кухонна сіль, кам’яна сіль Na2SO4 • 10H2O – глауберова сіль Na2CO3 – сода кальцинована NaNO3 – чилійська селітра |
K2CO3 – поташ ( у золі деяких рослин) KCl • NaCl – сильвініт KCl • MgCl2 • 6H2O – карналіт KCl • MgSO4 • 6H2O – каїніт К – входить до складу майже всіх рослин |
Інші елементи належать до рідкісних, і їх сполук у природі мало. Францій добуто штучно в результаті ядерних реакцій.
Фізичні властивості
Натрій і калій – метали сріблясто-білого кольору з незначними відтінками на свіжозрізаній поверхні, легкі, м’які, легко ріжуться ножем, легкоплавкі. На повітрі лужні метали легко окиснюються, тому блискуча поверхня свіжого зрізу металу швидко мутніє. Лужні метали зберігають в олії або їх покривають шаром гасу. Лужні метали добре розчиняються у ртуті, утворюючи амальгами. Температура плавлення натрію становить –97,8ºC (зменшується від літію до цезію). Натрій і калій мають високу електричну і теплову провідність. Внесені у полум’я пальника сполуки натрію забарвлюють полум’я у жовтий колір, а калію – у фіолетовий. Цю властивість використовують для розпізнавання цих сполук.
Лабораторний дослід 10. Ознайомлення зі зразками сполук натрію та калію
Завдання. Ознайомтеся із виданими вам зразками солей натрію і калію і заповніть таблицю. Назвіть галузі їх застосування.
| Назва | Формула | Зовнішній вигляд | Знаходження в природі | Застосування |
Хімічні властивості металів та їх сполук
Лужні метали найактивніші з усіх металів. Вони розміщені на початку електрохімічного ряду напруг металів. Реакційна здатність дуже велика. Уже при кімнатній температурі вони реагують з багатьма неметалами.
а) З воднем при нагріванні утворюють тверді речовини гідриди. Гідриди металів легко розкладаються водою з утворенням відповідного лугу і водню: 2Na + H2 = 2NaH; NaH + H2O = NaOH + H2.
б) Під час горіння натрію і калію в кисні утворюються пероксиди: 2Na + O2 = Na2O2.
Під час повільного окиснення або горіння в умовах недостачі кисню утворюються оксиди: 4Na + O2 = 2Na2O.
в) Внаслідок взаємодії з іншими неметалами (Cl2, N2, P, S, Si, Br2, J2, C) утворюються солі – тверді кристалічні йонні сполуки:![]() .
.
г) Калій і натрій бурхливо реагують з водою за звичайних умов з утворенням гідроксидів і водню: 2Na + 2H2O = 2NaOH + H2↑.
При взаємодії з водою кусочок натрію плавиться і набувши форму кульки «бігає» по поверхні води завдяки підштовхуванню його воднем, який виділяється. При взаємодії калію з водою утворений водень самозагоряється.
д) Натрій і калій енергійно взаємодіють з кислотами – слабкими окисниками HCl, H2SO4 (розбавлена), HBr, HJ, H2S тощо, з утворенням солі і водню: 2Na + 2HCl = 2NaCl + H2.
Під час реакції з кислотами – сильними окисниками HNO3 і концентрованою H2SO4 натрій і калій відновлюють Нітроген і Сульфур відповідних кислот до нижчих ступенів окиснення. Паралельно відбувається взаємодія цих металів з водою з утворенням водню. Ці реакції супроводжуються вибухом:
8Na + 10HNO3(розб) = 8NaNO3 + NH4NO3 + 3H2O;
8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O.
Добування
Натрій добувають електролізом розплавів натрій хлориду та натрій гідроксиду. Добувати калій електролізом KCl і KOH небезпечно і економічно не вигідно. Калій добувають так:
а) через розплавлений калій хлорид пропускають пару натрію при 800ºС, а пару калію що виділяється, конденсують KCl + Na = NaCl + K;
б) взаємодія розплавленого калій гідроксиду з рідким натрієм в реакційній колонці з нікелю: KOH + Na = NaOH + K.
Сполуки Калію та Натрію
Оксиди Na2O і K2O – основні. Це тверді речовини білого кольору. Добувають натрій оксид нагріваючи натрій в недостатній кількості кисню при температурі не вищій 180°С, або при нагріванні суміші натрій пероксиду з металічним натрієм: Na2O2 + 2Na = 2Na2O.
При взаємодії оксидів з водою утворюють гідроксиди: Na2O + H2O = 2NaOH.
Практичне значення має натрій пероксид, який взаємодіє з вуглекислим газом з виділенням кисню. Цю реакцію використовують на підводних човнах, космічних кораблях та закритих приміщеннях для регенерації повітря: 2Na2O2 + CO2 = 2Na2CO3 + O2.
Гідроксиди NaOH і KOH – білі, непрозорі, тверді кристалічні речовини, дуже гігроскопічні, милкі на дотик, вони роз’їдають шкіру і тканини, тому називаються їдкими лугами: KOH – їдке калі, NaOH – їдкий натр, каустик або каустична сода (в перекладі «пекуча»). Гідроксиди лужних металів не можна нагрівати в скляній, фарфоровій і платиновій посудині до плавлення, тому що в розплавленому стані вони роз’їдають скло, фарфор, а при доступі повітря і платину.
Виявляють усі властивості основ.
Тверді гідроксиди NaOН і KOH поглинають вологу на повітрі, завдяки чому використовуються для осушування газів. Тверді гідроксиди та їх водні розчини поглинають вуглекислий газ: NaOH + CO2 = NaHCO3.
У воді добре розчиняються з виділенням великої кількості теплоти. Розчини лугів змінюють колір індикаторів – фіолетовий лакмус синіє, а безбарвний фенолфталеїн стає малиновим. Луги взаємодіють з кислотами, кислотними оксидами та солями малоактивних металічних елементів:
2KOH + H2SO4 = K2SO4 + 2H2O (реакція нейтралізації)
2KOH + СO2 = K2СO3 + H2O
2KOH + CuCl2 = 2KCl + Cu(OH)2 (утворення нерозчинної основи)
Натрій утворює солі з усіма кислотами. Більшість солей білі, добре розчинні у воді.
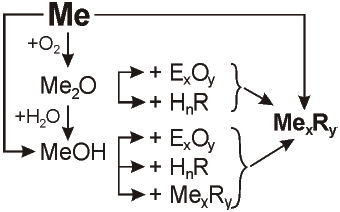
Хімічні властивості лужних металів та їх сполук
Застосування
NaCl – найважливіша із солей. Ця сіль необхідна нашому організму, тому ми вживаємо її в їжу. Її використовують для консервування харчових продуктів, добування натрій гідроксиду, соди, хлору, хлоридної кислоти.
Na2CO3 – для виробництва скла, твердого мила, пом’якшення води при фарбуванні, очистки замаслених деталей.
NaOH – для очистки нафтопродуктів, в паперовій і текстильній промисловості, виробництво штучних волокон, напівпровідників, мила.
NaHCO3 – харчова сода.
Na2SiO3 – рідке скло, силікатний клей.
NaNO3 – харчова приправа (азотне добриво).
K – теплоносій в ядерних реакторах, використовують у фотоелементах, в органічному синтезі.
Na – як каталізатор в оргсинтезі (виробництво каучуку), відновник тугоплавких металів, як теплоносій в ядерних реакторах, наповнювач газорозрядних натрієвих ламп, в сплавах із свинцем для виготовлення підшипників.
KOH – добування рідкого мила, електроліт в акумуляторах, очищувач повітря.
K2CO3 – для виробництва скла, рідкого мила, як мінеральне добриво.
KMnO4 – для дезінфекції.
K2Cr2O7 – дублення шкіри, виробництва оранжевих барвників.
Калій являє собою елемент, конче необхідний для живлення рослин. Натрій впливає на скорочення м’язів, забезпечує нормальне функціонування серцевого м’яза, регулює середовище організму. Натрій приймає участь у підтриманні кислотно-лужного балансу в організмі. Натрій у великій кількості міститься в рослинах, які ростуть на засолених ґрунтах. У цих рослинах він створює осмотичний тиск клітинного соку, завдяки чому вони вбирають воду із засолених ґрунтів.
Слід пам’ятати, що працювати із лужними металами й лугами можна, тільки захистивши очі окулярами або прозорим екраном.