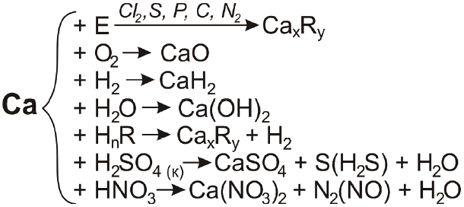Елементи другої групи головної підгрупи періодичної системи елементів Кальцій, Стронцій і Барій називають лужноземельними металами тому, що гідроксиди цих металів проявляють лужні властивості, а оксиди цих металів тугоплавкі і подібні до оксидів алюмінію і важких металів, які назвали землями. Пластичні метали, але значно твердіші за лужні метали, менш легкоплавні.
Відносна атомна маса Ca – 40, заряд ядра – 20.
Зовнішній електронний шар атома Кальцію складається з двох електронів. Віддаючи ці два електрони атом перетворюється на позитивно заряджений катіон Ca2+. У своїх сполуках Кальцій двовалентний.
Поширення у природі
Кальцій хімічно активний, тому зустрічається в природі тільки у вигляді сполук. За вмістом у земній корі він посідає п’яте місце. Найбільш поширеною сполукою є мінерал кальцит СаСО3 (головна складова частина вапняку, мармуру, крейди та прозора різновидність кальциту – ісландський шпат). Кальцій карбонат входить до складу мінералу доломіту – СаСO3•MgСO3, плавикового шпату СаF2, норвезької селітри Са(NO3)2, входить до складу алюмосилікатів. Часто зустрічаються поклади кальцій сульфату у вигляді мінералу гіпсу – СаSO4•2H2O. Кальцій у вигляді фосфату Са3(РО4)2 входить до складу фосфориту й апатиту. Йони Кальцію містяться у природних водах і ґрунті, в організмі тварин: в кістках (близько 80% кальцій фосфату), черепашках молюсків, яєчній шкарлупі.
Магній входить до складу силікатів, азбесту, тальку, доломіту, карналіту.
Фізичні властивості
Кальцій твердий, легкий, ковкий, легкоплавкий метал. Сполуки Кальцію забарвлюють полум’я у цегляно-червоний колір. Як і лужні метали, його зберігають під шаром гасу.
Лабораторний дослід 11. Ознайомлення зі зразками сполук кальцію та магнію
Завдання1. Ознайомтеся із виданими вам зразками солей натрію і калію і заповніть таблицю. Назвіть галузі їх застосування.
| Назва | Формула | Зовнішній вигляд | Знаходження в природі | Застосування |
Хімічні властивості кальцію
Кальцій є активним металом.
1) Взаємодія з неметалами: за звичайних умов кальцій легко вступає в реакцію з киснем повітря та галогенами, наприклад: Ca + Cl2 = CaCl2.
Під час нагрівання кальцій реагує з азотом, сіркою, вуглецем, фосфором і воднем, утворюючи солі – йонні кристалічні сполуки:
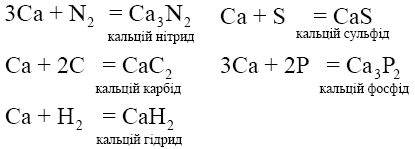 При нагріванні на повітрі кальцій згоряє, утворюючи кальцій оксид: 2Ca + O2 = 2CaO.
При нагріванні на повітрі кальцій згоряє, утворюючи кальцій оксид: 2Ca + O2 = 2CaO.
2) Взаємодіє з холодною водою повільно, а з гарячою – дуже енергійно з утворенням гідроксиду і водню: Ca + 2H2О = Ca(ОН)2 + H2.
Фенолфталеїн у добутому розчині набуває малинового забарвлення.
3) Кальцій активно реагує з кислотами: Ca + 2HCl = CaCl2 + H2.
4) Кальцій може відбирати Оксиген від оксидів та галоген від галогенідів менш активних металів, тобто має відновні властивості:
2Ca + TiO2 = 2CaO + Ti
2Ca + TiCI4 = 2CaCl2 + Ti
Добування кальцію
У промисловості кальцій добувають електролізом розплаву суміші кальцій хлориду CaCl2 і кальцій флуориду CaF2 у відношенні 3 : 1. Останній додають для зниження температури плавлення суміші.
Застосування
Завдяки великій хімічній активності металічний кальцій застосовують для відновлення деяких тугоплавких металів (титан, цирконій) з їхніх оксидів. Його використовують для очищення чавуну і сталі від домішок, для добування деяких сплавів (свинцево-кальцієвих), для виготовлення підшипників та оболонок кабелів.
Сполуки кальцію
Кальцій оксид CaO (технічні назви: негашене вапно, кипілка, палене вапно) – тугоплавна речовина білого кольору, температура плавлення 2570ºС, з яскраво вираженими основними властивостями.
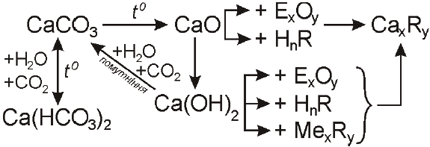
Добувають кальцій оксид окисненням кальцію: 2Ca + O2 = 2CaO; а в промисловості випалюванням вапняку при температурі 1000-1100ºС: CaCO3 ![]() CaO + CO2.
CaO + CO2.
Хімічні властивості
Як усі основні оксиди взаємодіє з кислотами та кислотними оксидами з утворенням солей.
CaO + 2HCl = CaCl2 + H2O
CaO + SO3 = CaSO4.
Оксид кальцію, зв’язуючи вуглекислий газ, перетворюється в карбонати: CaO + CO2 = CaCO3.
Взаємодію кальцій оксиду з водою, називають гашенням вапна, яке відбувається з виділенням великої кількості теплоти. Частина води при цьому перетворюється в пару, а шматочки оксиду розсипаються в крихку масу кальцій гідроксиду, який називають гашеним вапном: CaO + H2O = Ca(OH)2.
Кальцій оксид застосовують переважно для гасіння вапна. Його застосовують у промисловості як в’яжучий матеріал.
Кальцій гідроксид Ca(OH)2 – (гашене вапно) тверда речовина білого кольору погано розчинна у воді, у подрібненому стані його називають пушонкою.
Розчин (завись) вапна у воді називають вапняним молоком. Його застосовують для біління приміщень, вапнування дерев, у виробництві цукру. Безбарвний прозорий розчин Ca(OH)2 називають вапняною водою. Суміш гашеного вапна, піску і води називається вапняним розчином. Кальцій гідроксид має лужні властивості. Він взаємодіє з кислотами, кислотними оксидами та солями малоактивних металів.
Під час пропускання вуглекислого газу через вапняну воду, прозорий розчин мутніє, тому що утворюється нерозчинний у воді кальцій карбонат CaCO3. Ca(OH)2 + CO2 = CaCO3 + H2O. Це якісна реакція на йони кальцію.
У разі тривалого пропускання вуглекислого газу каламуть зникає, тому що кальцій карбонат перетворюється на розчинний у воді кальцій гідрогенкарбонат Ca(HCO3)2.
Ця реакція оборотна. Під час нагрівання розчин кальцій гідрогенкарбонату мутніє, оскільки утворюється нерозчинний кальцій карбонат і виділяється вуглекислий газ.
Ці реакції відіграють важливу роль у природі. Дощова вода розчиняє вуглекислий газ і, просочуючись крізь ґрунт, взаємодіє з вапняком, розчиняючи його у вигляді гідрокарбонату. Особливо ця реакція відбувається в товщах вапнякових порід. Коли така вода виходить на поверхню і випаровується, залишається кальцій карбонат. У результаті колообігу солей кальцію утворюються карстові печери, виникнення у них сталактитів і сталагмітів.
Хімічні властивості сполук кальцію
Застосування сполук
Кальцій, необхідний всім живим організмам: забезпечує ріст скелета, він прискорює роботу серцевого м’язу, необхідний для утворення цитоплазматичних мембран, впливає на в’язкість цитоплазми. Кров з пониженим вмістом Са2+ не згортається на повітрі, тому при найменшій подряпині це може призвести до втрати крові. Без Кальцію в ґрунтовому розчині не можуть нормально розвиватися корені, вони ослизнюються. При нестачі Кальцію в рослинах верхні пагони біліють, а потім з’являються жовтуваті плями. У кісточкових плодових дерев при цьому на корі виникають тріщини, з яких витікає клей, і значно погіршується або зовсім припиняється плодоношення. Ca(NO3)2 використовують як цінне нітратне добриво.
Гашене вапно в складі вапняного розчину, широко використовують в будівництві для скріплення цегли і штукатурки. З часом, вбираючи з повітря вуглекислий газ, суміш «тужавіє» внаслідок утворення кальцій карбонату, і стає настільки міцною, що коли ламаються старі будинки, тріщини проходять по цеглинах, а не по прошарках, що їх зв’язують.
З численних солей кальцію найпоширеніші в природі і найбільше практичне значення мають карбонати.
Крейда – для виробництва ґуми, фарби, зубного порошку.
CaCO3 – у будівництві, металургії, виробництві цементу, вапнуванні ґрунтів, видалення пустої породи при виробництві сталі і чавуну.
CaSO4•2H2O – у медицині.
CaSO4•H2O – у будівництві, виготовленні статуеток, поліпшенні структури ґрунтів.
Ca(OH)2 – в суміші з CuSO4 – «бордокська рідина» проти шкідників сільського господарства.