Хімічні елементи Оксиген, Сульфур, Карбон і Фосфор у вільному стані існують у формі кількох простих речовин.
Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою називають алотропією, а самі прості речовини – алотропними модифікаціями.
Термін увів Я. Берцеліус у 1841 р., що з грецької означає «інші властивості».
 Хімічний елемент Оксиген утворює дві прості речовини – кисень і озон, які є алотропними модифікаціями. Вони утворені одним і тим самим хімічним елементом, але відрізняються за складом молекул, фізичними і хімічними властивостями.
Хімічний елемент Оксиген утворює дві прості речовини – кисень і озон, які є алотропними модифікаціями. Вони утворені одним і тим самим хімічним елементом, але відрізняються за складом молекул, фізичними і хімічними властивостями.
Алотропні модифікації Оксигену
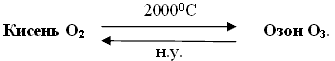 |
||
| У природі | У повітрі – 21% (за об’ємом), розчинений у воді. | Верхній шар атмосфери – постійно. На висоті 15-30 км шар товщиною 2-4,5 мм. У нижніх шарах атмосфери під час грози, в хвойних лісах при окисненні смолянистих речовин. |
| Ar, | 32 | 48 |
| Фізичні властивості | Газ безбарвний, без смаку і запаху tк –193°С, tпл –219°С. Погано розчинний у воді (1:3). При –183°С перетворюється в тверду речовину. | Газ блакитний, запах свіжості при невеликій концентрації і різкий в концентрованому стані, у зрідженому стані – темно-синій, у твердому стані – колір до чорного. Добре розчинний у воді (1:49). tк = –112°С, tпл = –251,4°С. Добувають у лабораторії за допомогою озонатора. |
| Фізіологічна дія | Не отруйний. У малій кількості забезпечує життєві процеси. | У малій кількості вбиває хворобливі мікроорганізми, у великій – дуже отруйний. |
| Хімічна активність | Активний окисник. | Реакційна здатність висока. Дуже сильний окисник внаслідок виділення атомарного Оксигену, не стійкий, вибухає при ударі, знебарвлює барвники, викликає самозагоряння деяких речовин. Хімічна активність дуже висока. |
| Застосування | Дихання, горіння, окиснення, заправлення ракет (рідина), зварювання і різання металів, окисник в металургії, добування вибухових речовин, HNO3, H2SO4, в медицині. | Дезінфекція води, повітря, усунення неприємного запаху, вибілювання тканин, окисник ракетного палива, захист планети від сонячної радіації. |
Озоновий шар і його значення
Озон – це природний надійний захисник усього живого на нашій планеті від згубної дії шкідливого сонячного випромінювання. Біля поверхні Землі озону мало. Більша концентрація його вдень, навесні і влітку над полярними частинами Землі. На висоті 15-30 км утворюється озоновий шар. Він затримує згубні для всього живого ультрафіолетові промені. Разом із СО2 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Озон дуже отруйний. Невеликі концентрації озону у повітрі створюють відчуття свіжості. Великі дози викликають подразнення дихальних шляхів, кашель, блювання, запаморочення, стомленість. Озон руйнує еритроцити крові, спричиняє глибокі спадкові зміни в генах людини. Невеликі довготривалі дози призводять до змертвіння серцевого м’яза. Концентрація озону в повітрі 0,00001% діє на організм так, як і 250 рентген радіації.
Озон у мінімальних дозах, виділений спеціальними приладами – озонаторами розщеплює молекули неприємних запахів у приміщенні, нейтралізує шкідливий вплив електричних і антенних сигналів, світлових вібрацій, позитивно впливає на організм людини.
Карбон існує у вигляді декількох алотропних модифікацій, які відрізняються між собою за фізичними властивостями. Загальна назва простих речовин Карбону – вуглець. У природі Карбон трапляється здебільшого у вигляді графіту й дуже рідко – у вигляді окремих кристалів алмазу.
Алотропні модифікації Карбону
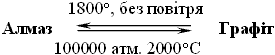 |
Карбін -С≡С-С≡С-Синтезований у 60-х рр. Є у природі в метеоритах (Уренгой, Баварія, Кратер Рис). Дрібнокристалічний порошок, чорний, напівпровідник, сама термостійка форма Карбону. Фулерен |
||
| Фізичні властивості | Самий твердий, прозорий, блискучий, сильно заломлює світло, добре проводить тепло, не проводить електричного струму, тугоплавкий. Колір – жовтий, безбарвний, коричневий, зелений, синій блакитний. | Кристалічний, м’який, чорний, жирний на дотик, має металічний блиск, добре проводить тепло і електричний струм. Відбиває світло, тугоплавкий, хімічно стійкий. | |
| Будова | Тетраедр. Кожен атом С сполучений із чотирма іншими атомами.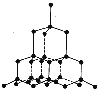 |
Шарувата, гексагональна.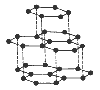 |
|
| Застосу- вання | Для свердління твердих порід, виготовлення шліфувальних дисків, різців, свердел, різання скла. У приладобудуванні, радіотехніці, виготовленні ювелірних виробів (діаманти). | Для виготовлення вогнетривких тиглів, синтетичних алмазів, мастил, електродів, труб, теплообмінників, грифелів для олівців. В ядерних реакторах як уповільнювач нейтронів. | |
| Аморфний вуглець (дрібні кристалики графіту) | |||
| Добування | Вугілля (С) (рослинне і тваринне). Обвуглювання деревини без доступу повітря. | Сажа (С). Спалювання органічних речовин при малій кількості повітря. | Кокс (С). Нагрівання кам’яного вугілля без доступу повітря. |
| Застосування | Виплавка чавуну і сталі, виробництво чорного пороху, фарб, для поглинання газів, очищення їх. Активоване вугілля – в медицині, виготовлення протигазів. Як каталізатор, очистка цукру від домішок, вловлювання цінних органічних розчинників. | Виготовлення лаків, фарб, туші, ґуми (як наповнювач), стрічки для друкарських машин, гуталіну. | Паливо в доменному процесі, відновник у металургії. Виготовлення електродів, легованих сталей. |
Аморфний вуглець не належить до окремих алотропних модифікацій, а є дуже дрібними кристаликами графіту.
Для тих, хто хоче знати хімію глибше
Алотропні модифікації фосфору
Відомо декілька алотропних модифікацій фосфору, які відрізняються між собою за фізичними властивостями. Існування цих модифікацій пояснюється різним типом їх кристалічних ґраток.
Алотропні модифікації фосфору
 |
|||
| Будова, фізичні властивості | tn = 44,10С, tk = 2750С. |
 Полімер, кристалічна ґратка – атомна, порошкоподібний. Полімер, кристалічна ґратка – атомна, порошкоподібний. |
Подібний до графіту, жирний на дотик, добре проводить електричний струм. Добутий у 1934 році американським фізиком Бріджменом. |
| Колір | Безбарвний з жовтуватим відтінком. | Темно-коричневий. | Фіолетовий добув у 1797 році Мусін-Пушкін. |
| Запах | Часниковий. | Немає. | |
| Густина | 1,8 | 2,3 | |
| Розчинність | У воді нерозчинний, розчинний у NH3, CS2, у бензині, легко випаровується | Нерозчинний у воді і органічних розчинниках | Коричневий добутий у лабораторії. |
| Світіння | Світиться у темряві. | Не світиться. | |
| Дія на організм | Дуже отруйний, доза 50 мг смертельна. | Не отруйний. | |
| Хімічні властивості | Легко окиснюється на повітрі, самозагоряється, опіки на тілі погано заживають. | При нагріванні без доступу повітря звітрюється, суміш з бертолевою сіллю займається при найменшому терті, не окиснюється на повітрі, горить. | |
| Застосування | Виробництво авіабомб, снарядів, раніше виготовляли статуетки, в годинниках, добування Н3РО4, добування твердого сплаву фосфористої бронзи. | Для виготовлення сірників, димових завіс, фосфорорганічних сполук, полімерів, проти корозії, напівпровідників, для знищення комах. | |
Кристалічна решітка сірки молекулярна і складається з вісьмиланкових кільцеподібних молекул S8. Як і всі речовини з молекулярною решіткою, сірка легкоплавка: вона плавиться при температурі, яка тільки трохи більша за температуру кипіння води, перетворюючись у прозору жовту, дуже рухливу рідину. Коли розплавлену сірку нагрівати далі, вона буріє і втрачає рухливість: якщо перекинути посудину, сірка вже не випливає з неї, а повільно стікає з її стінок як смола. Від швидкого охолодження перегрітої сірки утворюється коричнева, що просвічується маса, фізичними властивостями подібна до ґуми. Ця алотропна модифікація називається пластичною сіркою. Отже, якщо молекули розташовані щільно, утворюється алотропна модифікація ромбічна сірка. Менш щільне упакування молекул спричиняє утворення моноклінної сірки. Молекула пластичної сірки – це довгі ланцюжки з атомів Сульфуру. Дуже нагріта сірка закипає і переходить у пару бурого кольору.
Алотропні модифікації Сульфуру
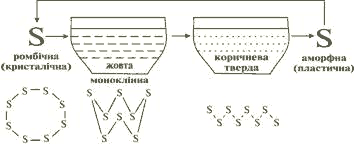
| Лимонно-жовта кристалічна, молекули упаковані щільно, крихка, ρ = 2,07 г/см3, tпл = 112,8°С. |
Блідо-жовта рідина, менш щільне упакування молекул, ρ = 1,96 г/см3, tпл = 119,3°С. |
Темно-коричнева в’язка маса, складається з довгих ланцюжків атомів, еластична, можна витягнути в нитку, не стійка, швидко загусає, твердне, стає крихкою. |

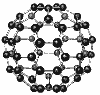 Молекулярна формула С60. Атоми Карбону з’єднані в кільце із 20 шестикутників і 12 п’ятикутників у формі футбольного м’яча. Добутий у США в 1985 р. Кристалічна, чорна речовина стійка на повітрі tпл = 360°C, ρ = 1,65 г/см3. розчинна в органічних речовинах. Перспектива – виробництво напівпровідникових плівок.
Молекулярна формула С60. Атоми Карбону з’єднані в кільце із 20 шестикутників і 12 п’ятикутників у формі футбольного м’яча. Добутий у США в 1985 р. Кристалічна, чорна речовина стійка на повітрі tпл = 360°C, ρ = 1,65 г/см3. розчинна в органічних речовинах. Перспектива – виробництво напівпровідникових плівок.















1 коментар
Іван
Чудово