Відносна атомна маса Алюмінію 26,98; заряд ядра +13.
Елемент Алюміній входить до третьої групи головної підгрупи. На зовнішньому енергетичному рівні він має три електрони, які досить легко відриваються, і тоді атом перетворюється на катіон Al3+. У сполуках Алюміній виявляє ступінь окиснення +3, валентність ІІІ.
Поширення у природі
Алюміній найпоширеніший у природі металічний елемент. Вміст його у земній корі становить 8,05% (за масою). Серед металічний елементів за поширенням у земній корі він посідає перше місце, серед інших елементів – третє.
Алюміній трапляється у природі лише в складі хімічних сполук. Відомо біля 250 мінералів, які містять цей елемент. Найважливіші природні сполуки – алюмосилікати, боксит, корунд та кріоліт. Алюмосилікати, до складу яких входять Алюміній, Силіцій і Оксиген, становлять основну масу земної кори. До них належить польовий шпат K2O•3Al2O3•6SiO2•2H2O; нефелін – Na2O•Al2O3•2SiO2, продукт їх вивітрювання – глина (каолініт) – Al2O3•2SiO2•2H2O. Боксити – Al2O3•хH2O – гірська порода, що складається переважно з оксиду алюмінію та оксидів феруму, які надають їм червоного кольору. Кріоліт – мінерал складу AlF3•3NaF. Корунд – Al2O3.
Фізичні властивості
Алюміній – сріблясто-білий легкий метал, дуже пластичний, міцний, добрий провідник теплоти і електричного струму. Легко піддається обробці: прокатується у листи і фольгу, витягується в тонкий дріт. Плавиться при 660ºC, тонка фольга плавиться в полум’ї сірника.
Хімічні властивості
Алюміній належить до активних металів. Однак на повітрі він досить стійкий, оскільки за звичайної температури швидко окиснюється, його поверхня вкривається дуже щільною плівкою оксиду, яка захищає метал від подальшого руйнування.
1. Взаємодія з киснем. Якщо з алюмінієвого дроту зняти захисну оксидну плівку, то алюміній починає енергійно взаємодіяти з киснем. Порошок алюмінію згоряє, утворюючи оксид:
4Al + 3O2 = 2Al2O3 + Q.
2. Взаємодія з водою. При звичайних умовах на алюмінієві вироби вода не діє навіть при температурі її кипіння, тому що алюміній оксид не взаємодіє з водою. Якщо видалити захисну оксидну плівку з поверхні алюмінію, він починає енергійно взаємодіяти з водяною парою повітря, перетворюючись на рихлу масу алюміній гідроксиду з виділенням водню і тепла:
2Al + 6H2O = 2Al(OH)3 + 3H2.
3. Взаємодія з неметалами. Алюміній реагує з сіркою, галогенами, вуглецем, азотом та всіма неметалами. Для початку реакції необхідне нагрівання. Далі реакція відбувається з виділенням великої кількості тепла. З воднем алюміній не взаємодіє.
4. Взаємодія з кислотами. Алюміній активно взаємодіє з багатьма кислотами, особливо з хлоридною з виділенням водню:
2Al + 6HCl = 2AlCl3 + 3H2.
Концентрована нітратна кислота при звичайних умовах не вступає в реакцію з алюмінієм. Пояснюється це тим, що нітратна кислота як сильний окисник робить оксидну плівку ще міцнішою. Тому цю кислоту можна зберігати і перевозити в алюмінієвому посуді. При звичайній температурі алюміній пасивується концентрованою сульфатною і розбавленою нітратною кислотами. У гарячій сульфатній кислоті алюміній розчиняється:
2Al + 4H2SO4(k) = Al2(SO4)3 + S + 4H2O.
5. Взаємодія з оксидами. Алюміній взаємодіє з оксидами більшості металів. Реакція проходить з виділенням великої кількості теплоти:
Cr2O3 + 2Al = 2Cr + Al2O3 + Q;
3Fe3O4 + 8Al = 4Al2O3 + 9Fe + Q.
Процес відновлення металів з їх оксидів називається алюмінотермією. Цей метод використовується у металургії для добування тугоплавких металів (титану, вольфраму, молібдену, ванадію, цирконію).
6. Взаємодія з солями. Металічний алюміній легко вступає в реакції з розчинами солей: 2Al + 3CuCl2 = 3Cu + 2AlCl3.
7. Взаємодія з лугами. На відміну від багатьох металів на алюміній дуже сильно діють розчини лугів, тому в алюмінієвому посуді не можна зберігати луги та лужні розчини. 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
Застосування алюмінію
Алюміній знаходить найширше застосування. У вигляді чистого металу використовується для виготовлення електричних проводів, фольги для кондитерської і харчової промисловості (як обгортковий матеріал), різної хімічної апаратури. Алюмінієм вкривають стальні та чавунні вироби, щоб захистити їх від корозії. Його сплави з різними металами дуже міцні й легкі. Вироби із них по міцності рівні стальним, але в три рази легші від них. Сплави використовують у авіа-, авто-, корабле- і приладобудуванні, в ракетній техніці і в будівництві, для оздоблення фасадів будинків, станцій метрополітену, гофрованими листами алюмінієвих сплавів покривають дахи, будують різні складські приміщення. Широко використовується в транспорті. З нього будують цистерни для транспортування нафтопродуктів, виготовляють вагони.
Широко застосовується «срібна» фарба на основі алюмінієвого порошку. Щоб захистити від сонячних променів цистерни для перевезення, їх покривають алюмінієвою фарбою.
У побуті використовують алюмінієвий посуд, столові набори. Сполуки алюмінію, які в невеликій кількості можуть утворюватися від дії на алюміній слабких органічних кислот неотруйні.
Алюміній оксид Al2O3 (глинозем)
Це речовина білого кольору, тугоплавка (температура плавлення 2000ºС), з дуже високою твердістю. Тонка, прозора й міцна плівка цього оксиду завжди покриває метал алюміній. У природі алюміній оксид зустрічається у вигляді корунду та глинозему. Природний корунд – дуже тверда речовина, який поступається твердістю тільки перед алмазом – застосовують його для виготовлення наждачних кругів, брусків для обробки (полірування) металевих та інших виробів та шліфувальних порошків. У природі зустрічаються прозорий різновид корунду, який може мати різне забарвлення: корунд забарвлений домішками сполук титану у синій колір, називають сапфіром; у фіолетовий – аметист; у червоний (від сполук хрому) – рубін. Це дорогоцінні камені. Рубін використовують для виготовлення втулок годинникових та інших точних механізмів. Глинозем використовують як сировину для добування алюмінію. Зневоднений алюміній оксид застосовують як адсорбент при очищенні та розділенні органічних речовин методом хроматографії.
За хімічними властивостями – це амфотерний оксид.
Реагуючи з кислотами, проявляє основні властивості, утворюючи солі, наприклад: Al2O3 + 6HCl ![]() 2AlCl3 + 3H2O
2AlCl3 + 3H2O
Стосовно лугів він поводиться як кислотний оксид. При сплавленні з лугами утворюються солі метаалюмінати: Al2O3 + 2NaOH = 2NaAlO2 + H2O.
У присутності води реакція з лугами відбувається інакше: Al2O3 + 2NaOH + 3H2O = 2NaAl(OH)4 – гідрат метаалюмінату натрію.
Це пояснюється тим, що у водному розчині натрій алюмінат приєднує одну або дві молекули води, що можна зобразити так:
а) NaAlO2 • H2O або NaH2AlO3;
б) NaAlO2 • 2H2O або NaAl(OH)4.
Алюміній оксид не розчиняється у воді і з нею не реагує. Свіжо одержаний оксид взаємодіє з кислотами і лугами, а сухий – не розчиняється ні в кислотах, ані в лугах.
Добувають алюміній оксид безпосереднім спалюванням порошку металічного алюмінію:
4Al + 3O2 = 2Al2O3, або розкладом алюміній гідроксиду при нагріванні:
.
Алюміній гідроксид Al(OH)3
Біла тверда речовина, що не розчиняється у воді, свіжо добутий алюміній гідроксид – це біла желеподібна маса, при висушуванні якої утворюється кристалічна речовина.
Алюміній гідроксид має амфотерні властивості.
Свіжоосаджений алюміній гідроксид легко розчиняється в кислотах та лугах (крім амоній гідроксиду):
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
При сплавленні з лугами утворюються метаалюмінати, а у водних розчинах – гідрати метаалюмінатів:
Al(OH)3 + NaOH ![]() NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3 + NaOH → NaH2AlO3 + H2O
При взаємодії з концентрованими розчинами лугів утворюються ортоалюмінати:
Al(OH)3 + 3NaOH → Na3AlO3 + 3H2O
Алюміній гідроксид розкладається при нагріванні. Алюміній гідроксид має властивість поглинати різні речовини, тому його застосовують для очистки води.
Добувають його дією лугів на солі алюмінію. Розчин лугу береться у малій кількості, тому що утворений алюміній гідроксид розчиниться у надлишку лугу.
Лабораторний дослід 13. Добування алюміній гідроксиду та доведення його амфотерності
1. Добування алюміній гідроксиду. Налийте у пробірку 2-3 мл розчину солі алюмінію і по краплинах доливайте розбавлений розчин лугу до утворення драглистого осаду.
Чому розчин лугу необхідно доливати краплями? Яка речовина випадає в осад? Запишіть рівняння проведеної реакції в молекулярній та йонній формах.
2. Властивості алюміній гідроксиду. Добутий осад розлийте у дві пробірки. В одну з них долийте розчин кислоти, а в другу – розчин лугу. Що відбулося? Які властивості характерні для алюміній гідроксиду. Запишіть рівняння проведених реакцій в молекулярній та йонній формах.
Хімічні властивості алюмінію та його сполук
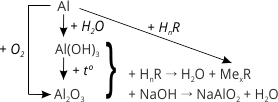
Застосування сполук алюмінію
AlCl3 – каталізатор в оргсинтезі.
Al2(SO4)3•18H2O – очистка води, протрава при фарбуванні тканин.
Al2O3 – виготовлення шліфувальних брусків, кругів, для різання та полірування металевих виробів, виготовлення вогнетривких матеріалів.
KАI(SO4)2•12H2O – алюмінієві галуни – кровозупинний засіб при порізах, примочки при запальних процесах слизових оболонок і шкіри. Галуни широко використовують для дублення шкіри, і протрава при фарбування бавовняних тканин.

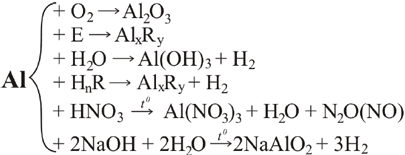


















1 коментар
ірина
дуже гарно…дякую…=)))