Більшість неметалічних елементів утворюють сполуки з Гідрогеном; їх не утворюють лише інертні елементи. Бінарні сполуки Гідрогену з неметалами назвали леткими тому, що за звичайних умов вони газоподібні (HCl, NH3, H2S), або рідини, що легко переходять у газоподібний стан (HF за температури 19,5°С і H2O). Ці сполуки складаються із молекул. Атоми в них сполучені між собою ковалентними полярними зв’язками. Для сполук неметалічних елементів з Гідрогеном найчастіше використовують тривіальні назви, рідше – хімічні.
Гідроген хлорид
 Гідроген хлорид (хлороводень) – безбарвний газ з різким характерним задушливим запахом. Він у 1,26 разів важчий за повітря. При атмосферному тиску і температурі –84°С гідроген хлорид переходить у рідкий стан, а при температурі –112°С – твердне. Сухий гідроген хлорид не вступає у взаємодію з металами, а при наявності слідів вологи реакція з активними металами відбувається енергійно. В 1 л води розчиняється до 500 л гідроген хлориду утворюючи хлоридну кислоту. «Туман», що з’являється при попаданні гідроген хлориду у вологе повітря – це дрібненькі краплинки хлоридної кислоти. Хлороводень сильно подразнює дихальні шляхи, тому досліди з ним слід проводити у витяжній шафі. Хлоридна кислота належить до сильних кислот і виявляє всі властивості кислот.
Гідроген хлорид (хлороводень) – безбарвний газ з різким характерним задушливим запахом. Він у 1,26 разів важчий за повітря. При атмосферному тиску і температурі –84°С гідроген хлорид переходить у рідкий стан, а при температурі –112°С – твердне. Сухий гідроген хлорид не вступає у взаємодію з металами, а при наявності слідів вологи реакція з активними металами відбувається енергійно. В 1 л води розчиняється до 500 л гідроген хлориду утворюючи хлоридну кислоту. «Туман», що з’являється при попаданні гідроген хлориду у вологе повітря – це дрібненькі краплинки хлоридної кислоти. Хлороводень сильно подразнює дихальні шляхи, тому досліди з ним слід проводити у витяжній шафі. Хлоридна кислота належить до сильних кислот і виявляє всі властивості кислот.
Якісна реакція на хлорид-йон. При взаємодії хлоридної кислоти і хлоридів із розчином арґентум нітрату випадає сирнисто-білий осад AgCl нерозчинний у воді та нітратній кислоті. Скорочене йонне рівняння якісної реакції: Ag+ +Cl– = AgCl↓.
Лабораторний дослід 2. Виявлення хлорид-йонів в розчині
Налийте в пробірку хлоридної кислоти, добавте 2-3 краплі розчину арґентум нітрату. Що спостерігаєте. Запишіть йонно-молекулярне рівняння проведеної реакції. Зробіть висновок про якісну реакцію на хлорид-йон.
Добування. У промисловості добувають гідроген хлорид спалюванням водню в атмосфері хлору: Н2 + Сl2 = 2HCl↑.
У лабораторії – за реакцією обміну між кухонною сіллю у твердому стані і концентрованою сульфатною кислотою при нагріванні: 2NaCl + H2SO4 = 2HCl + Na2SO4.
Гідроген хлорид і хлоридну кислоту використовують для добування синтетичного каучуку, пластмаси, очищення поверхні металів від продуктів корозії, добування хлору в лабораторії, переробки руд, здійснення гідролізу целюлози, виробництва хлоридів та інших продуктів.
Амоніак
Амоніак NH3 (аміак, гідроген нітрид) – безбарвний газ із характерним різким запахом, майже в два рази легший за повітря, дуже добре розчиняється у воді. За звичайних умов в одному об’ємі води розчиняється близько 700 об’ємів амоніаку. При підвищеному тиску або охолодженні до –33,6°С амоніак зріджується, а при –77,8°С твердне. Рідкий амоніак має велику теплоту випаровування, тому його використовують у холодильних установках. Розчин амоніаку у воді називають аміачною водою або нашатирним спиртом.
Фізіологічна дія. Вдихання малих кількостей амоніаку стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при втраті свідомості та отруєнні чадним газом. Вдихання великих кількостей подразнює слизову оболонку очей і дихальних шляхів. При попаданні в організм викликає нудоту, пронос, смерть від набряку гортані. При потраплянні в очі викликає сліпоту.
Хімічні властивості амоніаку
Амоніак – активна речовина.
1. Взаємодія амоніаку з киснем. Амоніак добре горить у кисні, гірше на повітрі. Він горить блідим, зеленуватим полум’ям. При горінні утворюється вільний азот і вода:![]() .
.
У цій реакції амоніак проявляє відновні властивості.
При участі каталізатора утворений азот також сполучається з киснем, тому продуктами реакції буде нітроген (ІІ) оксид: ![]() .
.
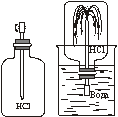
2. Взаємодія амоніаку з водою. Амоніак добре розчиняється у воді. Якщо в суху колбу заповнену амоніаком і закриту пробкою із вставленою трубкою з витягнутим кінцем, занурити у воду, до якої було додано кілька крапель фенолфталеїну, то з безбарвної рідини починає бити малиновий фонтан. Амоніак вступає в хімічну взаємодію з водою. У результаті реакції утворюється гідроксид амонію, про що свідчить зміна кольору індикатора.
В цій реакції до молекули амоніаку від молекули води приєднується атом Гідрогену, в результаті чого утворюється одновалентна група атомів NH4, яку назвали «амоній». Ця група атомів має позитивний заряд, тому її ще називають йоном амонію NH4+. Йони амонію притягують гідроксид-йони від молекули води, внаслідок чого утворюється гідроксид амонію: NH3 + H-OH ⇄ NH4OH.
Реакція взаємодії амоніаку з водою являється оборотною. Молекули гідроксиду амонію розпадаються на амоніак і воду, що легко встановити по запаху. Чим більша температура розчину, тим реакція у зворотному напрямку протікає швидше. При нагріванні розчинність амоніаку різко зменшується, і він звітрюється з розчину. Водний розчин амоніаку належить до слабких і нестійких основ.
3. Взаємодія з кислотами. Амоніак легко взаємодіє з кислотами. В цих реакціях до молекули амоніаку приєднується атом Гідрогену кислоти і утворюється йон амонію, який входить до складу солі. Наприклад, при взаємодії амоніаку з хлоридною кислотою утворюється сіль амоній хлорид: NH3 + HCl = NH4Cl.
Утворення хлориду амонію можна спостерігати на такому досліді: наблизимо одну до одної скляні палички, що змочені, одна – концентрованим розчином нашатирного спирту, друга – концентрованою хлоридною кислотою (рис. 1) між паличками з’являється білий дим. Цей дим складається з найдрібніших кристаликів амоній хлориду.
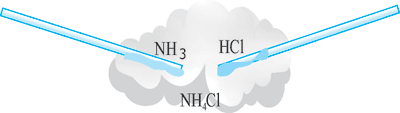
Рис. 1. Взаємодія хлоридної кислоти з амоніаком.
Гідроксид амонію проявляє основні властивості. Він взаємодіє з кислотами і кислотними оксидами:
NH4OH + H2SO4 = NH4HSO4 + H2O
2NH4OH + CO2 = (NH4)2CO3 + H2O
Застосування амоніаку. Амоніак – один із важливих продуктів хімічної промисловості. Він є вихідною речовиною для виробництва нітратної кислоти, нітратних добрив, вибухових речовин, барвників, лікарських речовин.
Випаровування рідкого амоніаку використовують у холодильних установках для створення штучного холоду. Штучний холод дає можливість перевозити продукти, що швидко псуються на будь-які віддалі, зберігати їх на складах.
У сільському господарстві водний розчин амоніаку (нашатирний спирт) використовують як рідке азотне добриво. У побуті нашатирний спирт використовують для виведення плям, чищення ювелірних виробів, килимів. Використовують у лабораторній практиці та медицині.

















