Положення металічних елементів у періодичній системі
 Вам уже відомо, що більшість хімічних елементів являються металічними. Ці елементи є в усіх групах періодичної системи. Перші три групи складаються тільки з металічних елементів, за винятком Гідрогену в першій групі та Бору в третій групі. У IV, V, VI групах металічні елементи в побічних підгрупах і унизу головних підгруп. Якщо в періодичній системі елементів Д. І. Менделєєва провести умовну діагональ від Берилію до Астату, то в головних підгрупах зліва від діагоналі, у побічних підгрупах та у восьмій групі (виключаючи інертні гази) – металічні елементи. До металічних елементів належать також лантаноїди і актиноїди.
Вам уже відомо, що більшість хімічних елементів являються металічними. Ці елементи є в усіх групах періодичної системи. Перші три групи складаються тільки з металічних елементів, за винятком Гідрогену в першій групі та Бору в третій групі. У IV, V, VI групах металічні елементи в побічних підгрупах і унизу головних підгруп. Якщо в періодичній системі елементів Д. І. Менделєєва провести умовну діагональ від Берилію до Астату, то в головних підгрупах зліва від діагоналі, у побічних підгрупах та у восьмій групі (виключаючи інертні гази) – металічні елементи. До металічних елементів належать також лантаноїди і актиноїди.
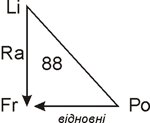
На зовнішньому електронному рівні атомів металічних елементів міститься 1–3 електрони, тому вони легко віддають ці електрони, та являються відновниками. Чим менше електронів на зовнішньому рівні, тим відновні властивості виражені сильніше. Радіус атомів металічних елементів більший за радіус атомів неметалічних елементів. У періодах найбільші радіуси мають атоми лужних металічних елементів.
У межах періоду:
а) зліва направо зростає заряд ядра атома і число електронів на зовнішньому електронному рівні, електрони сильніше притягуються ядром, тому відновні властивості спадають;
б) зростає валентність за Оксигеном.
У межах груп зверху вниз зростає радіус атома, електрони зовнішнього енергетичного рівня слабкіше притягуються ядром, тому відновні властивості зростають.
Валентність більшості металічних елементів рівна числу електронів на зовнішньому енергетичному рівні – I, II, III. Ступінь окиснення – 0, +1, +2, +3.
Металічний хімічний зв’язок
Металічні елементи утворюють прості речовини – метали. За звичайних умов це кристалічні речовини. Між металічними елементами виникає металічний зв’язок.
Металічний зв’язок – це зв’язок між позитивними йонами та відносно вільними електронами, що є спільними для всіх йонів.
Суть його полягає в тому, що атоми металічних елементів віддають свої електрони, які переміщуються по всій масі шматка металу. Атоми елементів, що віддали електрони, перетворюються на позитивно заряджені йони. Ці йони притягують до себе електрони, які вільно рухаються. У кристалі металу спільні електрони зв’язують багато йонів.
Металічний зв’язок де в чому подібний до ковалентного та йонного зв’язку, і водночас відрізняється від них. Подібність до ковалентного зв’язку полягає в тому, що між атомами існують спільні електрони. У випадку ковалентного зв’язку ці електрони спільні для атомів, що об’єднуються, але у випадку металічного зв’язку ці електрони спільні для всіх атомів даного куска металу. Металічний зв’язок дуже міцний. Такий особливий тип зв’язку обумовлює певні фізичні та хімічні властивості металів.
До йонного зв’язку металічний зв’язок подібний наявністю йонів. Проте в йонних сполуках існує зв’язок між протилежно зарядженими йонами, а в металах позитивно заряджені йони утримуються електронами, що вільно рухаються. Сам шматок металу в цілому електронейтральний. Оскільки електрони перебувають у безперервному русі, то при їх зіткненні з позитивно зарядженими йонами останні можуть перетворюватися в нейтральні атоми.
Кристалічні ґратки, у вузлах яких містяться позитивно заряджені йони і деяка кількість нейтральних атомів, між якими рухаються відносно вільні електрони, називаються металічними.
Фізичні властивості металів
Металічні елементи утворюють прості речовини метали. Усі метали, крім ртуті, за звичайних умов тверді речовини.
Металічний блиск. У компактному стані метали мають характерний металічний блиск, тому що метали відбивають від своєї поверхні світлові промені, а не пропускають їх як скло, і майже не вбирають, тому є непрозорими. Найкраще відбивають світло індій та срібло, тому їх використовують для виготовлення дзеркал. Метали відбивають радіохвилі.
Ковкість і пластичність. Багато металів пластичні і добре куються. Оскільки йони в металічній ґратці один з одним безпосередньо не зв’язані, то окремі їхні шари можуть вільно переміщатися один відносно одного під дією зовнішніх сил. Пластичність – це здатність легко змінювати форму під дією зовнішніх сил і зберігати одержану форму після припинення цієї дії. Найбільш пластичним є золото. Пластичність зменшується в ряду: Au, Ag, Cu, Sn, Pb, Zn, Fe. Чим більша кількість електронів на зовнішньому енергетичному рівні, тим міцніші зв’язки між окремими шарами йонів, тим пластичність буде нижча.
Електрична провідність і теплопровідність. Метали – добрі провідники електрики і теплоти. Це зумовлено наявністю в металічних ґратках вільних електронів, які в електричному полі набувають спрямованого руху. Найбільшу електропровідність має срібло. Електропровідність і теплопровідність металів збільшується від Hg до Ag (Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag). Оскільки срібло дороге, в електротехніці використовують мідь і алюміній. З підвищенням температури посилюється коливання атомів (йонів, що утруднює спрямований рух електронів, що призводить до зменшення електропровідності.
Густина. За густиною метали поділяють на легкі (густина яких не перевищує 5000 кг/м3) – літій, натрій, магній, алюміній, і важкі (густина яких понад 5000 кг/м3) – цинк, залізо, мідь, свинець, ртуть. Найважчий – осмій, найлегший – літій.
Твердість. За твердістю метали поділяють на тверді (найтвердіший хром і вольфрам – ріжуть скло), і м’які (найм’якішими є натрій, калій, індій, цезій, рубідій). Вони легко ріжуться ножем.
За температурами плавлення розрізняють легкоплавкі (tпл. до 1000°C) та тугоплавкі (tпл. понад 1000°C). Найбільш легкоплавкий метал ртуть (–38,9°C), цезій (+29°C) і галій (+29,8°C). Вольфрам – найбільш тугоплавкий метал (+3410°C). Він застосовується для виготовлення ниток електроламп.
Колір. Майже всі метали (за винятком золота та міді) мають білий або сірий колір з різними відтінками. У подрібненому (порошкоподібному) стані більшість металів набувають чорного або темно-сірого кольору. Розрізняють чорні метали (Fe, Mn, Cr) і кольорові (всі інші). Кольорові метали за різними ознаками поділяють на підгрупи: рідкісні (літій, рубідій, цезій, берилій, молібден, вольфрам, цирконій, гафній, тантал), розсіяні (галій, індій, талій, германій), радіоактивні (радій, торій, уран, актиній), рідкісноземельні (скандій, ітрій, лантан).
Магнітні властивості – це здатність притягуватися магнітом. Магнітні властивості характерні для заліза, нікелю, кобальту.
Лабораторний дослід 9. Ознайомлення зі зразками металів
Завдання1. Ознайомтеся із зовнішнім виглядом, кольором, ковкістю, пластичністю виданих вам зразків металів. Назвіть галузі їх застосування.
Завдання 2. З’ясуйте за довідковою літературою температури кипіння та плавлення цих металів.
Метали в природі
За місцем металу в електрохімічному ряді напруг можна пояснити, чи є метал у природі вільним (у самородному стані), чи у вигляді хімічних сполук. Метали, що стоять в електрохімічному ряду напруг до водню, знаходяться в земній корі практично тільки в хімічних сполуках. Срібло, мідь, олово можуть існувати в природі як у самородному стані, так і у вигляді сполук. У самородному стані перебувають найменш активні метали – золото і платина.
Найпоширенішим металічним елементом у земній корі є Алюміній. Активні металічні елементи зустрічаються переважно у вигляді солей, а менш активні – у вигляді оксидів і сульфідів.
Поширення деяких металів у природі (% за масою):
| Al | Fe | Ca | Ti | Mn | Cr | Zn |
| 8,05 | 4,65 | 3,6 | 0,6 | 0,1 | 0,02 | 0,01 |


















