Солі нітратної кислоти називають нітратами. Нітрати лужних металів, кальцію і амонію ще називають селітрами, наприклад: KNO3 – калієва селітра; NaNO3 – натрієва (чилійська) селітра; Ca(NO3)2 – кальцієва (норвезька) селітра; NH4NO3 – аміачна селітра.
Всі нітрати – тверді кристалічні речовини, добре розчинні у воді, малостійкі при високій температурі. На відміну від хлоридів, які плавляться, не розкладаючись, нітрати розкладаються при температурі близькій до температури їх плавлення. Продукти розкладання бувають різні, залежно від хімічної активності металу, що входить до складу солі. Розклад нітратів можна зобразити схемою:
Розклад нітратів при нагріванні
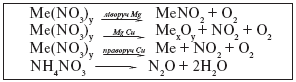
Наприклад:
1. Солі металічних елементів до Mg при розкладанні утворюють нітрити і кисень:
2NaNO3 → 2NaNO2 + O2.
2. Солі металічних елементів від Mg до Cu при розкладанні утворюють основний оксид, нітроген(IV) оксид і кисень:
2Cu(NO3)2 → 2CuO + 4NO2 + O2.
3. Солі металічних елементів розташованих в ряду активності металів після Cu утворюють метал, нітроген оксид і кисень:
2AgNO3 → 2Ag + 2NO2 + O2.
Лабораторний дослід 6. Ознайомлення зі зразками нітратів і солей амонію
Ознайомтеся з виданими вам зразками солей нітратної кислоти й амонію. З’ясуйте колір, розчинність у воді, запах. Одержані результати запишіть у таблицю:
| Назва солі | Формула солі | Колір | Запах | Розчинність у воді |
Якісна реакція на нітрат-йон
Нітратна кислота і нітрати містять нітрат-іон NO3–. Для визначення нітрат-іона NO3– у пробірку вміщують трішки досліджуваної речовини, добавляють мідних ошурків, вливають концентрованої сульфатної кислоти і нагрівають. Виділення бурого газу NO2 свідчить про наявність нітрат-іонів.
Схематично це можна зобразити так:
![]()
Наприклад:
KNO3 + H2SO4 → KHSO4 + HNO3(k)
4HNO3 + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O
Застосування нітратів
- Нітрати використовують переважно як добрива.
- Нітрати лужних металів використовують як компоненти ракетного палива.
- KNO3 використовують для виробництва чорного пороху.
- KNO3, NaNO3 – у малих кількостях використовують для виробництва м’ясних продуктів, деяких сортів сиру (надають м’ясним продуктам червоно-коричневого кольору).
- AgNO3 – для виробництва дзеркал, в гальванотехніці, в аналітичній хімії, невеликі дози в медицині як в’яжучий і бактерицидний засіб.
- Ba(NO3)2, Sr(NO3)2, Pb(NO3)2 – у піротехніці.
Проблема вмісту нітратів у харчових продуктах
Через застосування інтенсивних технологій вирощування рослин, які передбачають використання великої кількості мінеральних добрив, нітрати накопичуються у продуктах. Багато нітратів у ковбасах, молоці, 80% нітратів потрапляє в організм із рослин. Їх більше у ранніх овочах, овочах захищеного ґрунту. Високий вміст нітратів містить редис, редька, дині, кабачки, яблука, буряк.
Самі нітрати не отруйні, але в організмі вони перетворюються на отруйні речовини – нітрити, які взаємодіють з гемоглобіном крові окиснюючи Fe2+ до Fe3+. Замість гемоглобіну утворюється метгемоглобін, який втрачає червоне забарвлення і набуває темно-коричневого кольору. Метгемоглобін не здатний переносити кисень. Виникає киснева недостатність, порушується тканинне дихання. Як наслідок виникають ерозивні гастрити, порушення діяльності щитовидної залози, серцево-судинної системи. Крім того, під дією нітритів в організмі утворюються канцерогенні речовини, що спричиняють онкологічні захворювання. Найбільш чутливі до нітритів діти, хворі та люди старшого віку.
Зменшити кількість нітратів можна, якщо овочі, плоди перед вживанням ретельно промити гарячою водою, після чого яблука, огірки почистити, а з моркви вирізати серцевину. Зниження шкідливого впливу на організм нітратів і нітритів сприяє вживання вітамінів, особливо А, Е, В9.
Вміст нітратів можна визначити індикаторним папером ДФА (дифеніламіну) за такою шкалою:
| Забарвлення паперу ДФА | Вміст нітратів |
| яскраво-синій | дуже високий |
| синій | високий |
| світло-синій | середній |
| блакитний | низький |
| світло-блакитний | відсутній |


















