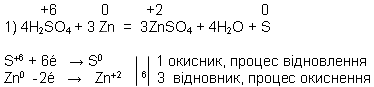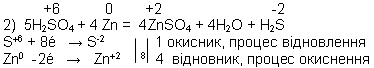Фізичні властивості
Сульфатна кислота – безбарвна рідина, важка, майже вдвічі важча за воду, в’язка як олія. Змішується з водою у будь-яких співвідношеннях. При кімнатній температурі вона нелетка й тому не має запаху. Під час розчинення сульфатної кислоти у воді відбувається дуже сильне розігрівання за рахунок утворення стійких гідратів сульфатної кислоти. Якщо вливати воду в кислоту, то частина води, не встигнувши змішатися з кислотою, одразу нагрівається до кипіння. Це викликає розбризкування кислоти і може спричинити опіки.
Концентрована сульфатна кислота поглинає багато вологи. Якщо відкриту склянку з концентрованою кислотою зрівноважити на терезах, то незабаром шалька зі склянкою опуститься. Тому цю кислоту використовують для висушування речовин. Концентрована кислота обвуглює папір і тканину. Потрапляючи на шкіру, вона спричиняє сильні опіки, тому під час роботи з кислотою необхідно бути дуже обережним. Кислоту, яка потрапила на шкіру або на тканину треба відразу змити великою кількістю води, потім розчином питної соди і знову змити водою.
Хімічні властивості
Сульфатна кислота – це сильна кислота. У водному розчині вона дисоціює за схемою: H2SO4 → H+ + HSO4–; HSO4– → H+ + SO42–.
Кислота змінює колір індикаторів: фіолетовий лакмус стає червоним, а метиловий оранжевий – рожевим. Розведена сульфатна кислота має загальні властивості характерні для всіх кислот: вона взаємодіє з металами, основними оксидами, основами та солями. Як двохосновна кислота, вона утворює два роди солей: середні і кислі в залежності від кількісного співвідношення речовин, що реагують.
| Кислота | Кислотний залишок |
Характер солі |
Загальна формула cолі, назва | Приклад |
| H2SO4 | − HSO4 | кисла | Me(HSO4)х гідрогенсульфати |
KHSO4 – калій гідрогенcульфат Ва(HSO4)2 – барій гідрогенcульфат |
| = SO4 | середня | Meх(SO4)у сульфати |
K2SO4 – калій сульфат CaSO4 – кальцій сульфат |
Кислі солі – це продукти неповного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Середні солі – це продукти повного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Хімічні властивості сульфатної кислоти
1. Взаємодія з металами
Розведена сульфатна кислота взаємодіє з металами які в ряду активності стоять до водню, з виділенням водню й утворенням солі. Наприклад: H2SO4 + Zn = ZnSO4 + H2.
2. Взаємодія з основними оксидами
Сульфатна кислота взаємодіє з основними й амфотерними оксидами з утворенням солі й виділенням води, наприклад: CuO + H2SO4 = CuSO4 + H2O
або в йонно-молекулярній формі: CuO + 2H+ = Cu2++ H2O
Цей тип реакцій застосовують на металообробних заводах для очищення поверхні металевих виробів, які зазнавали в процесі виготовлення сильного нагрівання. Цю операцію називають травленням металу.
3. Взаємодія з основами
Сульфатна кислота взаємодіє з основами з утворенням солі й виділенням води, наприклад: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
або в йонно-молекулярній формі: Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
4. Взаємодія з солями
Як сильна нелетка кислота, сульфатна кислота витісняє інші кислоти із сухих солей. Наприклад: H2SO4 + 2KCl → К2SO4 + 2HCl↑.
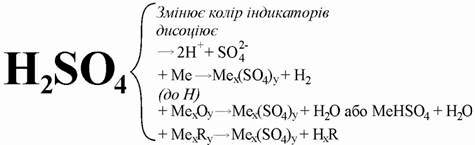
Концентрована сульфатна кислота
з багатьма металами за звичайної температури не взаємодіє. Тому безводну кислоту можна зберігати в залізній тарі. Однак при нагріванні вона взаємодіє майже з усіма металами (крім платини і золота). Під час цих реакцій залежно від активності металу може виділятися сірка, гідроген сульфід або сульфур(IV) оксид. Реакція відбувається за схемою:
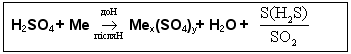
Наприклад: