Існують різні форми наукових знань, зокрема факти, поняття, теорії, закони. Створенню будь-якої теорії завжди передують спостереження, дослідження певних фактів, об’єктів, явищ. Факти – це реальні події чи конкретні характеристики, достовірні дані, установлені в процесі наукового пізнання. Поняття є узагальненою думкою про тіла, речовини, явища тощо, яка виникає на підставі багатьох фактів. Більш розвиненою й досконалішою формою наукових знань, ніж факти і поняття, є теорія. Теорія об’єднує наукові знання в певну систему.
Теорію перевіряють на практиці. Для цього здійснюють багато додаткових спостережень і досліджень, аналізують суть запропонованої теорії. Залежно від результатів такої перевірки нові факти й відкриття доповнюють і розширюють існуючі теорії, а іноді, навпаки, доводять її неспроможність і хибність. Хибною, наприклад, виявилася теорія флогістону. Теорія будови органічних сполук виявилася достовірною і завдяки використанню сучасних методів дослідження невпинно розвивається.
Теорія хімічної будови органічних сполук О. М. Бутлерова
Теорія О. М. Бутлерова – це вчення про можливе розташування та взаємний вплив атомів у молекулах органічних речовин. До створення Бутлеровим цієї теорії органічна хімія являла собою суму не пов’язаних між собою відомостей про колосальну кількість органічних речовин. Наука не була спроможною пояснити, чому атом Карбону утворює таку велику кількість сполук, чому різні речовини, що мають однаковий кількісний і якісний склад, відрізняються за своїми властивостями. Значні труднощі виникли при визначенні валентності атомів Карбону в органічних сполуках. Вчені-хіміки не могли пояснити і те, чому органічних речовин значно більше, ніж неорганічних. Тому в середині XIX століття виникла нагальна потреба у створенні теорії хімічної будови органічних сполук.
Передумови створення теорії будови органічних сполук
Ряд відомих учених внесли свій вклад у створенні теорії будови органічних сполук:
- розробка вчення про валентність (англійський вчений Є. Франкланд, 1852 р.).
- розвиток уявлення про чотиривалентність атомів Карбону (німецький вчений Ф. А. Кекуле, 1857 р.)
- положення про здатність атомів Карбону сполучатися не лише з атомами інших елементів, а й між собою (шотландський хімік А. С. Купер, 1858 р).
- утвердження атомно-молекулярного вчення (1860 р., міжнародний з’їзд хіміків у м. Карлсруе).
- були встановлені точні формули багатьох неорганічних та органічних речовин.
Проте ці вчені не змогли поєднати розрізнені факти в цілісну наукову теорію.
Російський вчений Олександр Бутлеров був першим, хто теоретично обґрунтував і експериментально довів, що будову органічних сполук можна з’ясувати хімічним способом, і навпаки, знаючи будову речовин, можна передбачити її властивості. У 1858 році в Парижі на зібранні хімічного товариства О. М. Бутлеров поділився думкою про структуру органічних сполук. У 1861 році на з’їзді німецьких лікарів та натуралістів у м. Шпейєрі він сформулював основні ідеї будови органічних сполук. А у 1864-1866 роках він видав підручник «Вступ до повного вивчення органічної хімії», у якому предмет було викладено на основі нової теорії будови.
Суть теорії будови органічних сполук можна звести до таких положень:
1. У молекулах органічних речовин атоми сполучені один з одним у певній послідовності відповідно до їх валентності, наприклад:
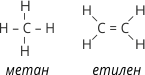
2. Властивості органічних речовин залежать не лише від їхнього складу, а й від будови молекул, наприклад:
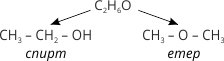
3. Атоми або групи атомів, що утворили молекулу, взаємно впливають один на одного, що впливає на реакційну здатність речовин. Наприклад: в молекулі пропілену під впливом радикалу поляризується π-зв’язок. При взаємодії з полярними молекулами галогеноводнів атом Гідрогену приєднується до найбільш гідрогенізованого атома Карбону при подвійному зв’язку:
![]()
4. За хімічною будовою можна визначити властивості речовини, а за хімічними властивостями – їхню будову.
Оскільки положення теорії пов’язані з будовою молекул, її назвали структурною. Теорія хімічної будови О. М. Бутлерова є найважливішою частиною теоретичного фундаменту органічної хімії. За значенням її можна порівняти з періодичною системою елементів Д. І. Менделєєва. Для підтвердження своєї теорії Бутлеров виконав ряд експериментів. Теорія Бутлерова пояснила причину різноманітності органічних сполук, дала можливість не тільки систематизувати всі органічні речовини, а й пояснити їх властивості, теоретично передбачити існування невідомих і нових речовин, знайти способи їх синтезу. На підставі теорії було синтезовано сотні органічних сполук, чим доведена її правильність.
Свій подальший розвиток теорія отримала в працях багатьох вчених світу.
Нині відомо, що на властивості органічних сполук впливає не лише порядок розміщення атомів у молекулі, а й її геометрична (просторова) форма, розподіл електронів між атомами, зміщення спільних електронних пар, інші особливості електронної будови. Реакційна здатність органічних сполук залежить від направленості і енергії зв’язку, полярності, будови молекул та природи атакуючих їх реагентів.
Направленість зв’язку
Із всіх атомних орбіталей лише s-орбіталі мають сферичну будову, а всі інші певним чином орієнтовані в просторі. У зв’язку з цим ковалентний зв’язок, який виникає при перекриванні різних електронних хмар по-різному орієнтованих у просторі і визначає розташування атомів у молекулі. В залежності від способу перекривання і симетрії утворених хмар розрізняють σ-(сигма) й π-(пі) зв’язки.
Зв’язок, утворений унаслідок перекривання орбіталей із неспареними електронами двох атомів на ділянці, розміщеній на лінії, що з’єднує центри атомів, називають сигма-зв’язком (σ-зв’язком). Це можливо при взаємодії двох s-електронів (рис. 1А), одного s- і одного p-електрона (рис. 1Б), двох p-електронів (рис. 1В).
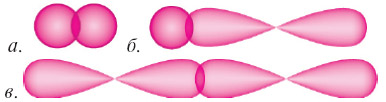
Рис 1. Перекривання: А) s-s, Б) s-p, В) p-p електронних хмар й утворення σ-зв’язку
Зв’язок, утворений унаслідок перекривання орбіталей із неспареними електронами двох атомів на двох ділянках, розміщеній поза лінією, що з’єднує центри атомів називають π -зв’язком (пі-зв’язком).
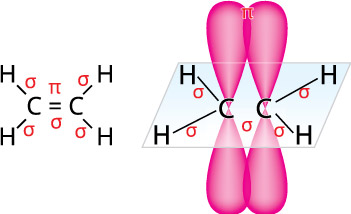
Рис. 2. Утворення π-зв’язку в молекулі етилену
Такий тип зв’язку виникає в молекулах етилену й ацетилену.
Зв’язки з низькою енергією проявляють себе в хімічних реакціях в першу чергу. Порівнюючи енергію зв’язків С-С (350 кДж/моль, ковалентний неполярний), С-Н (415 кДж/моль, слабополярний), С-Cl (330 кДж/моль, сильно полярний), можна зробити висновок про найбільшу реакційну здатність зв’язку С-Cl.
Гібридизація
Для органічних сполук характерна гібридизація: початкова форма електронних хмар взаємно змінюється і утворюються хмари нової, але уже однакової форми. Гібридизація орбіталей валентних електронів відбувається у момент утворення зв’язків, оскільки вона вигідна в енергетичному відношенні.
Комбінація хмар одного s- і трьох p-електронів призводить до sp3-гібридизації, при якій чотири гібридних хмарки симетрично орієнтовані в просторі до чотирьох вершин тетраедра, тобто під кутом 109º28′. Така гібридизація характерна для насичених вуглеводнів.
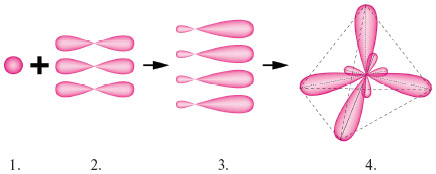
Рис. 3. Схема вирівнювання (гібридизація) s- і p-електронних хмар в атомі Карбону.
1. Взаємодія однієї s- й трьох p-електронних хмар. 2. Утворення чотирьох гібридизованих хмар. 3. Розташування гібридизованих хмар в просторі. 4. Утворення молекули метану.
Комбінація хмар одного s- і двох p-електронів приводить до sp2-гібридизації. Така гібридизація характерна для етиленових вуглеводнів. Комбінація хмар одного s- і одного p-електрона приводить до sp-гібридизації. Така гібридизація характерна для ацетиленових вуглеводнів.


















