Хімічні властивості визначають здатність речовин до певних хімічних перетворень. Хімічні властивості виявляються лише в процесі перетворення одних речовин на інші, і вони залежать від того, які саме атоми, молекули входять до її складу і як вони зв’язані між собою. Так здатність водню горіти і здатність кисню підтримувати горіння і є їх хімічною властивістю. Властивістю крейди є її здатність реагувати з кислотами. У результаті реакції із суміші реагентів із шипінням виділяється вуглекислий газ. Вуглекислий газ не підтримує горіння.
Спостереження й експеримент у хімії
Хімічні властивості речовин вивчають експериментально, тобто ставлять досліди.
Дуже важливо навчитися правильно переливати рідини. Пляшку з рідиною беруть у руку так, щоб етикетка була повернена в сторону долоні, тоді залишки рідини не потраплятимуть на напис і не псуватимуть його. Краєм отвору пляшки з якої переливають рідину торкаються отвору похилої посудини в яку переливають, і обережно наливають необхідну кількість рідини. Наливати рідину в склянку можна за допомогою скляної палички. Для перемішування рідини у склянці або колбі використовують довгу скляну паличку. Якщо палички немає, пробірку беруть трьома пальцями ближче до отвору та обережно струшують вміст. Забороняється закривати отвір пробірки пальцем, а потім інтенсивно струшувати рідину.
Експеримент (від латинської «experimentum» – «проба», «дослід»), зокрема хімічний немає нічого спільного з безцільним, випадковим маніпулюванням предметами і речовинами. Якщо учень почне безладно зливати речовини зі склянок, що стоять на столі, то його дії аж ніяк не можна назвати експериментом. Дослідник починає експеримент з того, що формулює питання, на яке хоче отримати відповідь.
Подивимося на властивості води з точки зору хіміка. Відомо, що у воді розчиняється вуглекислий газ. У такому стані він міститься у розчинах газових напоїв і мінеральній воді. А чи відбувається при цьому хімічна реакція? У пробірку з водою додамо кілька крапель фіолетового лакмусу і пропустимо в неї вуглекислий газ. Розчин набуває рожевого кольору.
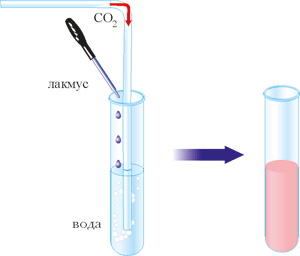
Рис. 59. Розчинення вуглекислого газу у воді.
Водночас з розчиненням вуглекислого газу у воді відбувається хімічна реакція – утворення вугільної кислоти, тому колір індикатора зміниться.
Схема реакції: Вода + вуглекислий газ → вугільна кислота.
У чашку з водою добавимо кілька крапель безбарвного фенолфталеїну і вмістимо невеликий шматочок калію. Починається енергійна взаємодія: калій розчинається у воді, виділяється газ, а розчин набуває малинового забарвлення. Реакція проходить дуже енергійно, так що калій може навіть загорітися.

Рис. 60. Взаємодія калію з водою.
Газ можна зібрати у пробірку і підпалити. Це – водень. Зміна кольору індикатора вказує на лужне середовище. Таке середовище дає утворений калій гідроксид.
Схема реакції: Вода + калій → водень + калій гідроксид.
Підсумок:
- Хімічні властивості речовин – це їх здатність до певних хімічних перетворень.
- Будь-який хімічний експеримент починається із спостереження.
?
- Які властивості речовитн називаються фізичними, а які – хімічними?
- Що таке хімічний експеримент?
- Наведіть приклади хімічних реакцій в побуті.
Домашній експеримент
Малювання йодом
 Візьміть будь-який, непридатний для вжитку залізний предмет, очистіть його поверхню до блиску. Предмет злегка нагрійте і накрапайте на нього свічковий парафін, який розпливеться тонким шаром. Коли парафін охолоне, голкою продеріть канавки, щоб вони дійшли до металу. У них накрапайте піпеткою аптечний йод, який через кілька хвилин поблідніє. Знову залийте канавки йодом.
Візьміть будь-який, непридатний для вжитку залізний предмет, очистіть його поверхню до блиску. Предмет злегка нагрійте і накрапайте на нього свічковий парафін, який розпливеться тонким шаром. Коли парафін охолоне, голкою продеріть канавки, щоб вони дійшли до металу. У них накрапайте піпеткою аптечний йод, який через кілька хвилин поблідніє. Знову залийте канавки йодом.
Приблизно через годину зніміть парафін і ви побачите на металі сліди, які відображають нанесений вами малюнок.
Таким способом ви можете наносити будь-який малюнок, наприклад, помітити свої ключі.
Практична робота 2. Дослідження фізичних і хімічних властивостей речовин
Мета навчання: навитися проводити хімічні реакції, спостерігати і описувати властивості речовин.
Речовини і обладнання: мармур (крейда), хлоридна кислота, вапняна вода, вуглекислий газ, мідний купорос, залізо (цвях). Штатив з пробірками, сірники, чиста скляна трубка.
Дослід 1. Взаємодія мармуру з водою і кислотою
Опустимо в дві пробірки по кілька шматочків мармуру або крейди і добавимо в одну воду, а в другу – 1-2 мл розчину хлоридної кислоти. У першій пробірці змін не спостерігаємо, а в другій проходить бурно реакція з виділенням газу.
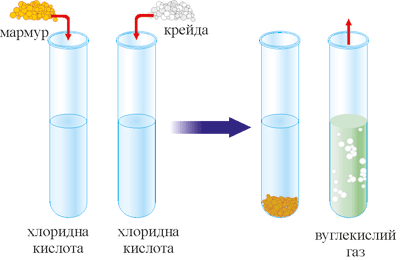
Рис. 61. Взаємодія мармуру з хлоридною кислотою.
До отвору пробірки піднесемо запалений сірник, він гасне.
Схема реакції: Мармур + хлоридна кислота → кальцій хлорид + вуглекислий газ.
Який газ виділився? Чому сірник гасне? Чи розчинявся мармур у воді? Які властивості речовин ви спостерігали?
Дослід 2. Взаємодія вуглекислого газу з вапняною водою.
У пробірку з прозорим розчином вапняної води пропускаємо вуглекислий газ (можна видихати вуглекислий газ у вапняну воду через чисту скляну трубочку). Спостерігаємо помутніння вапняної води.
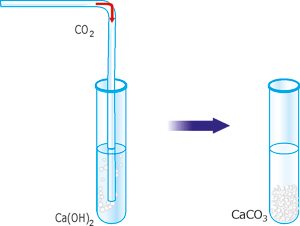
Рис. 62. Взаємодія вуглекислого газу з вапняною водою.
Схема реакції: Вапняна вода + вуглекислий газ → крейда + вода.
Чому помутніла вода? Які речовини утворилися?
Дослід 3. Взаємодія заліза з розчином мідного купоросу.
Опустіть цвях на ниточці у розчин мідного купоросу. Зверніть увагу на колір мідного купоросу і колір цвяху. Через декілька хвилин вийміть цвях із розчину.
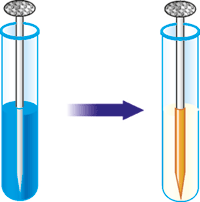
Рис. 63. Взаємодія заліза з розчином мідного купоросу.
Як змінився колір мідного купоросу? Яким став колір цвяха?
Схема реакції: Мідний купорос + залізо → мідь + залізний купорос.
Який метал відклався на поверхні заліза? Чому цвях набув брунатного кольору?
Хід дослідів та їх результати занесіть до таблиці:
| № досліду | Що робили? | Що спостерігали? | Чи відбулась хімічна реакція? |


















