Властивості простих речовин металів розглянемо на прикладі заліза.
 Ферум – хімічний елемент
Ферум – хімічний елемент
Символ хімічного елемента – Fe
Відносна атомна маса – Ar (Fe) – 55,8
Атомний номер – 26
Валентність елемента у сполуках – ІІ, ІІІ.
Елемент Ферум утворює просту речовину – залізо, формула якого – Fe.
Залізо як проста речовина
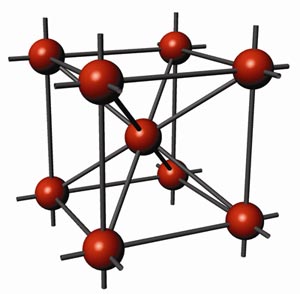
Рис. 77. Кристалічна ґратка Fe
Фізичні властивості заліза
Лабораторна робота №4. Вивчення фізичних властивостей заліза
Мета: спостереження фізичних властивостей заліза.
Тіла: залізний дріт, цвях, кнопки, скрепки.
Завдання: розгляньте видані вам залізні тіла. Який колір металу? Чи має металічний блиск? Попробуйте зігнути залізний дріт. Чи він пластичний?
Помістіть залізне тіло у склянку з водою. Чи розчиняється цей метал у воді? Важчий чи легший він за воду? З’ясуйте, чи притягується залізо магнітом.
Результат спостережень занесіть у таблицю:
| Фізичні властивості | Залізо | |
| 1 | Агрегатний стан за кімнатної температури | |
| 2 | Колір, блиск | |
| 3 | Запах | |
| 4 | Розчинність у воді | |
| 5 | Твердість, пластичність | |
| 6 | Намагнічування | |
| 7 | Електропровідність |
Як видно із досліду за звичайних умов залізо – блискучий, сріблясто-білий метал із сіруватим відтінком. Чистий метал досить м’який і пластичний, легко кується, прокатується у листи і витягується у дріт. Залізо притягується магнітом, у полум’ї пальника не плавиться, дріт важко зламати. Густина заліза 7,87 г/см3, температура плавлення + 1539ºС. Залізо електропровідне, хоча його електропровідність нижча, ніж в алюмінія.
Хімічні властивості заліза
Залізо належить до металів середньої хімічної активності.
Взаємодія заліза з киснем
Нагріте до високої температури залізо горить у кисні.
Якщо до тонкого сталевого дроту прикріпити шматочок сірника, запалити його і швидко опустити в колбу заповнену киснем, то від сірника, який горить, займеться й залізо. Воно горить, розкидаючи яскраві іскри залізної окалини, яка осідає на стінках колби у вигляді брунатних крапок:
3Fe + 2O2 = Fe3O4.

Рис. 78. Горіння заліза.
У результаті розжарення на повітрі залізо окиснюється з поверхні, утворюючи залізну окалину Fe3O4 у вигляді кірки, що відшаровується від ударів молота під час кування. Іскри, які вириваються при точінні стального інструмента або викидаються під час розливання чавуну, являють собою розжаренні частинки тієї самої окалини.
Чисте залізо на повітрі стійке. На практиці використовується залізо з домішками. Поверхня такого заліза за звичайних умов вкривається оксидною плівкою, але її захисні властивості невисокі, внаслідок такого окиснення залізо руйнується.
Під час нагрівання залізо взаємодіє з багатьма неметалами.
Взаємодія заліза із сіркою
Під час нагрівання залізних ошурків і порошку сірки утворюється ферум(ІІ) сульфід.
Приготуємо 3,5 г суміші з однакової кількості заліза і сірки. Для досліду візьмемо порошок відновленого заліза і порошок сірки. Розмішаємо суміш скляною паличкою. Висипемо одержану суміш у пробірку, закріплену вертикально в штативі. Нагріємо спочатку всю суміш, а потім дно пробірки. Як тільки суміш розжариться, нагрівання припиняємо.
Спостерігаємо за ходом реакції. Утворюється ферум(ІІ) сульфід, чорного кольору: Fe + S = FeS.
Взаємодія заліза з хлором
Залізо згоряє в хлорі (рис. 79) з утворенням ферум(ІІІ) хлориду.
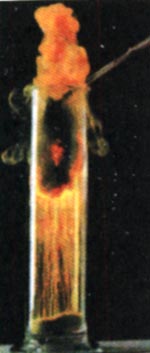
Рис. 79. Взаємодія заліза з хлором
Фізіологічна дія
Сполуки Феруму мають велике значення у житті рослин, тварин і людини.
У рослин Ферум входить до складу цитоплазми, приймає участь у процесі фотосинтезу. У разі нестачі Феруму хлорофіл не утворюється, рослини втрачають здатність поглинати вуглекислий газ і хворіють. Рослини вирощені на субстраті без вмісту цього елемента мають біле листя. При внесенні невеликих доз Феруму в ґрунт рослини набувають зеленого кольору.
В організмі дорослих людей біля 3,5 г Феруму. Основна його маса входить до складу дихального пігменту крові – гемоглобіну, який переносить кисень від органів дихання до різних тканин, а вуглекислий газ СО2 – від тканин до органів дихання. Гемоглобін, а точніше еритроцити, забарвлюють кров у червоний колір, тому еритроцити ще називають червонокрівцями. В організм Ферум потрапляє з їжею.
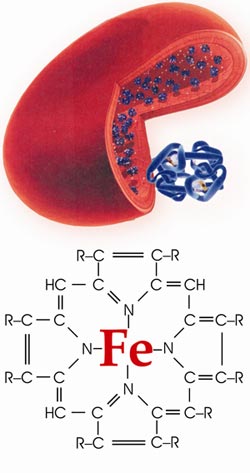
Рис.80. Еритроцит крові.
Підсумок
- Елемент Ферум утворює просту речовину – залізо.
- Залізо проявляє властивості, характерні для металів:
- сріблясто-сірий метал, має металічний блиск;
- м’який, пластичний, ковкий;
- тепло-, електропровідний;
- притягується магнітом.
- Хімічно малоактивний. За підвищеної температури горить, взаємодіє з неметалами.
- Елемент необхідний для живих організмів.
?
- Дайте характеристику елемента Феруму.
- Яку просту речовину утворює Ферум?
- Охарактеризуйте фізичні властивості заліза.
- З якими речовинами взаємодіє залізо?
- Яка роль Феруму у життєдіяльності організмів?
Цифри і факти
Вміст Феруму в 100 г продуктів (мг):
- квасоля – 12,4
- печінка – 9,8
- гречана крупа – 8
- шпінат – 3
- яйця – 2,7
- хліб – 2,8
- яблука – 2,2
- молоко – 0,1
Вміст Феруму в організмі (у відсотках):
- кістковий мозок, плазма, ферменти – 1
- печінка – 10-15
- м’язи – 20-22
- кров – 65-70
Із усього Феруму, який потрапляє до організму, засвоюється лише 6-20%. Краще засвоюється із м’яса, риби, бобів. Процес засвоєння проходить краще в присутності аскорбінової кислоти і фруктози, які є у фруктах, тому м’ясні продукти рекомендують споживати з овочами, фруктами.
При нестачі Феруму в організмі виникають головні болі, кволість, легка стомлюваність, поганий настрій, анемія.
Однією з причин анемії є недостатня кількість еритроцитів в організмі – так звана «залізодефіцитна анемія». Коли Феруму недостатньо, червонокрівці не можуть нормально дозрівати. У результаті клітини будуть менші та блідніші. У більшості випадків допомагає лікування препаратами Феруму.
За царювання Петра І для лікування використовували мінеральну воду. Названу «марціальною», на честь Марса – бога війни і заліза.
Допитливим
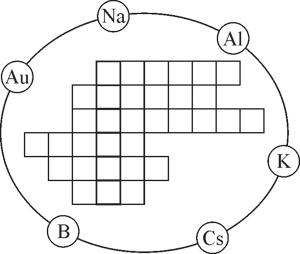
У шести колах зображені знаки хімічних елементів. Розташуйте назви простих речовин утворених цими елементами по горизонталі у клітинках таким чином, щоб у вертикальному стовпчику, виділеному жирними лініями можна було прочитати назву поширеної на Землі речовини.
Домашній експеримент
Золоте перо
 У розчин мідного купоросу опустіть залізне перо. Воно вкривається золотистим нальотом міді і стає неначе позолочене. При цьому відбувається реакція:
У розчин мідного купоросу опустіть залізне перо. Воно вкривається золотистим нальотом міді і стає неначе позолочене. При цьому відбувається реакція:
CuSO4 + Fe = FeSO4 + Cu.
Залізо здатне витісняти менш активні метали з розчинів їх солей.


















