Більш детально властивості простих речовин неметалів розглянемо на прикладі кисню.
Оксиген як хімічний елемент
Оксиген (від слова Оxygenium – «той, що народжує вогонь») – це неметалічний елемент, оскільки він утворює прості речовини які є неметалами. Оксиген – один із найпоширеніших елементів у природі.
 Символ елемента – О.
Символ елемента – О.
Атомний номер – 8 (тому що, в ядрі атома 8 протонів, а навколо ядра рухається 8 електронів)
Відносна атомна маса – Ar(O) = 16.
Валентність у сполуках – ІІ.
Кисень як проста речовин
Пригадай! Які речовини називаються «простими»?
Елемент Оксиген утворює дві прості речовини кисень (О2) й озон (О3).
Молекула кисню складається з двох атомів Оксигену. Кисень – найпоширеніша і найважливіша проста речовина Оксигену. Разом з азотом і незначною кількістю інших газів він утворює атмосферу Землі (входить до складу повітря 21% по об’єму). Розчиненим у воді киснем дихають рослини і тварини.
 Хімічна формула простої речовини кисню – О2.
Хімічна формула простої речовини кисню – О2.
Відносна молекулярна маса кисню: Mr(O2) = 32;
Молярна маса: M(O2) = 32г/моль.
Фізичні властивості кисню
За звичайних умов це безбарвний газ без смаку, запаху і кольору, трохи важчий за повітря (Mr повітря = 29), малорозчинний у воді. При температурі +20ºС у 100 л води розчиняється близько 3 л кисню.
У разі охолодження під тиском до температури –183ºС він перетворюється на блакитну рідину, яка за температури –219ºС твердне, утворюючи сині кристали.
Кисень можна «перелити» з посудини, де він знаходиться, в іншу посудину як звичайну рідину, тому що він важчий за повітря.
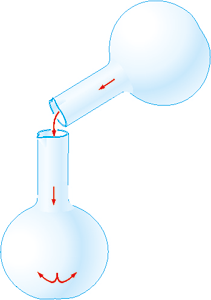
Рис. 65. Переливання кисню.
Утворення кисню в природі
У природі кисень утворюється у зелених рослинах внаслідок фотосинтезу із вуглекислого газу і води під дією сонячного світла. Спрощено схему цього процесу можна зобразити так: СО2 + Н2О ![]() О2 + органічні речовини.
О2 + органічні речовини.
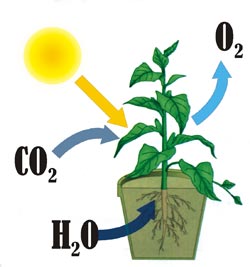
Рис. 66. Фотосинтез.
За допомогою штучних супутників виявлено, що значну масу кисню наша Земля отримує від частинок водяної пари. У найвищих шарах атмосфери під дією сонячної радіації молекули води розпадаються на водень і кисень.
Добування кисню
У лабораторії кисень добувають розкладом деяких складних оксигеновмісних сполук.
1. Дуже чистий кисень добувають розкладом калій перманганату. Якщо зібрати прилад, як показано на рис., і в пробірці нагрівати калій перманганат KMnO4, то в циліндрі над водою почне збиратися кисень, витискуючи з циліндра воду. Під час нагрівання калій перманганат розкладається на три нові речовини: калій манганат (K2MnO4), манган(IV) оксид (MnO2) і кисень (О2). Розкладання калій перманганату можна виразити таким хімічним рівнянням:
2KMnO4 = K2MnO4 + MnO2 + O2 ↑.
Вата необхідна для того, щоб затримати тверді продукти реакції розкладу.
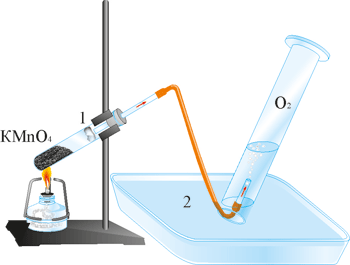
Рис. 67. Добування кисню і збирання його витісненням води: 1 – вата; 2 – вода.
2. Добути кисень можна також нагріванням калій хлорату KClO3 (бертолетової солі). Розкладання цієї солі відбувається дуже повільно, тому, щоб прискорити його розклад, реакцію проводять за наявності MnO2. Калій хлорат спочатку плавиться, а потім бурхливо розкладається на дві речовини – кисень і калій хлорид (KCl):
2KClO3 ![]() 2KCl + 3O2 ↑.
2KCl + 3O2 ↑.
Манган (ІV) оксид при цьому не витрачається і до складу продуктів реакції не входить. Він служить каталізатором.
Каталізатори широко використовують у промисловості. Вони прискорюють хімічні реакції, а отже, підвищують продуктивність хімічних процесів.
3. Добувати кисень можна також розкладом гідроген пероксиду за наявності каталізатора манган(IV) оксиду (MnO2):
2H2O2 ![]() 2H2O + O2 ↑
2H2O + O2 ↑
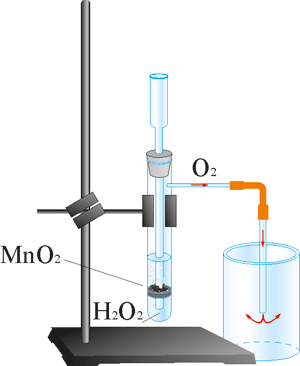
Рис. 68. Прискорення реакції розкладання гідроген пероксиду за наявності манган(IV) оксиду. Кисень збирають методом витіснення повітря.
4. Джозеф Прістлі добував кисень, нагріваючи меркурій(ІІ) оксид (HgO) за допомогою великої скляної лінзи, що фокусувала на сполуці сонячне світло:
2HgO ![]() 2Hg + O2 ↑.
2Hg + O2 ↑.
5. Кисень можна добути також розкладом води постійним електричним струмом:
2H2O ![]() 2H2O + O2 ↑.
2H2O + O2 ↑.
Отже, у результаті цих реакцій з однієї речовини утворюється кілька нових речовин. Такі реакції належать до реакцій розкладу.

У промисловості кисень добувають із повітря. Спочатку повітря піддають глибокому охолодженню, аж до його перетворення на рідину. Потім температуру добутого рідкого повітря поступово підвищують. Першим з нього починає виділятися газ азот, а рідина збагачується киснем. (Температура кипіння рідкого азоту –196ºС, кисню –183ºС).
Збирання кисню
Добутий кисень можна зібрати двома способами:
- витісненням води;
- витісненням повітря.
Оскільки кисень мало розчиняється у воді, він витісняє воду із циліндра. Гази, які у воді розчиняються, у такий спосіб зібрати неможливо.
Кисень трохи важчий за повітря, тому посудину, в яку збирають кисень, витісненням повітря тримають дном донизу.
Щоб переконатися, що посудина наповнилася киснем, до її отвору підносять жевріючу скіпку. Якщо посудина наповнилася киснем по самі вінця, скіпка спалахує біля її шийки. Щоб зберегти кисень для дослідів, його збирають у газометр витісненням з нього води.
Чистий кисень зберігають у газоподібному стані під тиском у балонах, пофарбованих у блакитний колір.
Підсумок
- Кисень – проста речовина, утворена двома атомами Оксигену.
- Добувають кисень розкладом деяких складних оксигеновмісних сполук:
- У реакціях розкладу з однієї речовини утворюється дві або більше речовин.
- Каталізатори – речовини, які прискорюють хімічні реакції.
- Збирають кисень витісненням повітря і води.
?
- Який хімічний елемент найпоширеніший у земній корі?
- Що таке каталізатор?
- Що ви знаєте про хімічний елемент Оксиген?
- Які прості речовини утворює елемент Оксиген?
- Дайте характеристику кисню.
- Які фізичні властивості кисню ви знаєте?
- З яких речовин можна добути кисень?
- Як перевірити наявність кисню в пробірці?
- Які реакції називають реакціями розкладу?
Для допитливих
Світовий пріоритет відкриття кисню належить Китаю. У VIII столітті китайський учений Моа-Хао встановив наявність в повітрі газу, що підтримує дихання і горіння.

Карл Вільгельм
Шеєле (1742–1786)
Шведський хімік. У 1772 році встановив, що повітря складається з кисню й азоту.
На початку XVII століття винахідник підводного човна К. Дреббель виділив кисень і використовував його на своєму човні. Його винахід мав військовий характер, тому відомості були засекречені.

Джозеф Прістлі
(1733–1804)
Англійський учений. У 1774 році розкладанням меркурій(ІІ) оксиду добув кисень і вивчив його властивості.
Кисень відкрили майже одночасно два видатні хіміки другої половини XVIII століття – швед К. Шеєле й англієць Джозеф Прістлі. Шеєле добув кисень раніше, але його трактат «Про вогонь і повітря» був опублікований у 1777 році, пізніше, ніж повідомлення Прістлі. Провівши серію дослідів, він дійшов висновку, що повітря містить «вогняний» газ, який підтримує дихання і горіння (кисень) і «зіпсований» газ, який горіння не підтримує (азот). Помер Шеєле у віці 44 років. Причиною смерті було отруєння речовинами, які він добував.
Д. Прістлі добув кисень розкладанням меркурій(ІІ) оксиду світлом від збільшувального скла.
«Мене здивувало, – писав Прістлі, – більше, ніж я міг передати словами, що свічка в цьому газі горіла надзвичайно блискучим полум’ям». Прістлі впустив одну мишу в посудину зі звичайним повітрям, а другу – в таку ж посудину, але з газом, який він добув. Перша миша скоро задихнулася, а друга в цей час ще почувалася добре і жваво рухалася. Прістлі й сам спробував дихати добутим газом і переконався, що дихати ним особливо легко і приємно.
В англійському місті Лідсі є бронзова скульптура молодої людини в модному одязі другої половини XVIIІ століття: на голові у нього – перука, у правій руці – збільшувальне скло, а в лівій – тигель. Так був увіковічнений у пам’яті людей видатний учений Д. Прістлі.
Ґрунтовним дослідником властивостей кисню вважають французького хіміка А. Лавуазьє, який, на відміну від попередників, що тільки відкрили новий газ, створив кисневу теорію горіння. Він довів, що кисень є складовою частиною повітря, а Оксиген входить до складу багатьох речовин.
Домашній експеримент
Попіл – каталізатор
 Спробуємо запалити шматочок рафінаду в полум’ї спиртівки. Цукор при цьому не загоряється, а лише плавиться і набуває темного забарвлення. Посипте поверхню цукру попелом від цигарки і знову внесіть його в полум’я спиртівки. Цукор загориться і буде горіти рівним блакитним полум’ям навіть поза полум’ям спиртівки.
Спробуємо запалити шматочок рафінаду в полум’ї спиртівки. Цукор при цьому не загоряється, а лише плавиться і набуває темного забарвлення. Посипте поверхню цукру попелом від цигарки і знову внесіть його в полум’я спиртівки. Цукор загориться і буде горіти рівним блакитним полум’ям навіть поза полум’ям спиртівки.

















