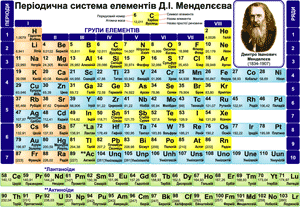
Періодична система елементів Д. І. Менделєєва
У хімії, як і в кожній науці, систематизація фактичного матеріалу значно допомагає його вивченню. Можна сказати, що сучасна хімія починає свою справжню історію з відкриттям періодичного закону хімічних елементів, що належить великому російському вченому Д. І. Менделєєву. Цей закон і його графічне відображення – періодична система елементів – основа вивчення хімічних елементів.
Подивіться на періодичну систему Д. І. Менделєєва: кожному елементу відведена окрема клітинка у таблиці. Всі елементи пронумеровані. Періодична система відображає природну класифікацію елементів. Природний порядок елементів базується на кількості протонів у їхньому ядрі і починається елементом Гідрогеном. Елемент Гідроген містить у ядрі атома один протон, тому йому присвоєно порядковий номер один. Елемент номер два – Гелій містить у ядрі два протони. Елемент номер три – Літій містить у ядрі три протони. У кожного наступного елемента плавно збільшується по одному протону в ядрі.
Кожний елемент посідає саме своє місце, тому, що номер хімічного елемента у періодичній системі дорівнює числу протонів у ядрі його атома.
Елементи розмістили у ряди і стовпчики. У клітинці записано символ елемента, його порядковий номер, назву елемента, значення відносної атомної маси. У тих випадках, коли назви простих речовин утворених даним елементом і назви елемента різняться, наведено обидві назви.
Із періодичної системи ми будемо брати необхідні нам відомості про хімічний елемент.
Маса атома
Хіміки у лабораторії зважують потрібні їм речовини і традиційно масу виражають у міліграмах, грамах або кілограмах. А чи можна на практиці зважити один такий атом? Звичайно ні! Звичайні терези непридатні для визначення мас найдрібніших частинок речовини – атомів і молекул. Відомо, що маси і розміри атомів дуже малі. Сучасні методи досліджень дають змогу визначити надзвичайно малі маси атомів з високою точністю. Наприклад, маса найлегшого з атомів – атома Гідрогену (ma) становить 1,67·10-27 кг або 0,000 000 000 000 000 000 000 000 00167 кг, маса атома Оксигену (ma) – 2,655·10-26 кг, ma Карбону – 1,993·10-26 кг.
Атомна одиниця маси
Виконувати розрахунки з великими числами незручно. У зв’язку з цим виникла необхідність в одиниці вимірювання мас атомів і молекул, зручній для практичної роботи. Вчені домовились вживати не абсолютні, а відносні атомні маси. Відносна атомна маса є безрозмірною величиною і вказує у скільки разів маса даного атома більша за деяку масу, обрану за еталон. Еталоном спочатку була маса найлегшого атома – атома Гідрогену.
Тепер таким еталоном є атомна одиниця маси (а.о.м.), яка дорівнює 1/12 маси атома Карбону. Чому 1/12 атому Карбону? Тому що атом Карбону майже у 12 разів важчий за атом Гідрогену. Цю маленьку масу назвали атомною одиницею маси.
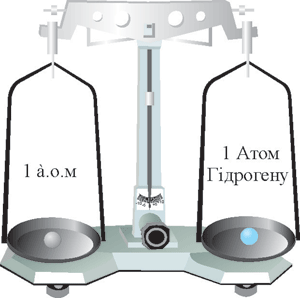
Рис. 39. Відносна атомна маса Гідрогену.
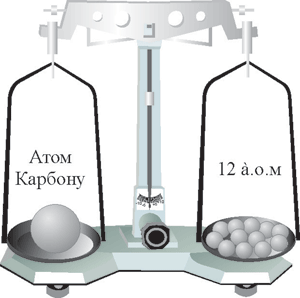
Рис. 40. Відносна атомна маса Карбону.
Як визначили атомну одиницю маси? Для цього абсолютну масу атома Карбону поділили на 12.
![]()
Відносна атомна маса
Маси атомів усіх хімічних елементів хіміки порівнюють із значенням однієї а.о.м. і одержують відносні атомні маси. Для цього абсолютні значення атомних мас елементів ділять на числове значення атомної одиниці маси. Відносна атомна маса позначається символом Ar («а-ер»), де А – перша літера грецького слова «атомос» – «неподільний», r – перша літера латинського слова «relativus» – «відносний»:
Математичний вираз:
![]() , або
, або ![]() , або
, або ![]() .
.
Приклад.
а) Визначимо відносну атомну масу Натрію:
ma(Na) = 3,8164 · 10–26 кг, тоді
![]()
Отже, Ar(Na) ≈ 23.

Рис. 41. Відносна атомна маса Натрію.
Приклад.
б) Визначимо відносну атомну масу Гідрогену:
ma(H) = 1,674 · 10–27 кг, тоді
![]()
Отже, Ar(H) ≈ 1.
в) Визначимо відносну атомну масу Оксигену:
ma(О) = 2,655 · 10–26 кг, тоді
![]()
Отже, Ar(О) ≈ 16.
Це означає, що маса одного атома Гідрогену наближено дорівнює 1/12 частині маси атома Карбону, а маса одного атома Оксигену у 16 разів (заокруглено) більша за 1/12 частину маси атома Карбону, тобто за 1 а.о.м. Літери «а.о.м.» біля числового значення відносної атомної маси, як правило, не зазначають.
На практиці слово «відносна» часто не називають і відносну атомну масу називають просто атомною масою.
Відносні атомні маси визначені для всіх елементів і зазначені в періодичній системі елементів. Ми будемо користуватись округленими атомними масами. Якщо після коми стоїть число більше п’яти, ми додамо одиницю, а якщо менше п’яти – ми його враховувати не будемо. За винятком атома Хлору, для якого приймаємо Ar(Cl) = 35,5.
Приклад.
| Назва хімічного елемента | Абсолютна маса атома, кг | Маса атома (а.о.м.) | Відносна атомна маса (заокругл.) |
| Гідроген | 1,674 · 10–27 | 1,00794 | 1 |
| Оксиген | 2,655 · 10–26 | 15,9994 | 16 |
| Сульфур | 5,32 · 10–26 | 32,06 | 32 |
Підсумок
- Атомна одиниця маси являє собою величину, що дорівнює 1/12 маси атома Карбону.
- Відносна атомна маса – це фізична величина, що визначається відношенням маси атома до 1/12 частини маси атома Карбону.
- Значення відносної атомної маси і маси атома вираженої в а.о.м. чисельно збігаються.
?
- Які відомості про елементи ми можемо взяти із періодичної системи?
- Яке числове значення атомної одиниці маси?
- Що таке відносна атомна маса елемента?
- Чому під порядковим номером елемента розуміють протонне число?
Допитливим
Атомну масу можна одержати підсумувавши маси протонів і нейтронів. Оскільки маса протонів і нейтронів в атомних одиницях маси виражається цілими числами, то і маса атомів повинна виражатися цілим числом. Чому в більшості хімічних елементів атомні маси дробові? Це пояснюється тим, що в ядрах атомів того ж самого хімічного елемента може бути різна кількість нейтронів. Атоми того самого елемента, які відрізняються масою, називають ізотопами. Слово походить від грецьких слів «isos» – «однаковий» і «topos» – «місце», що підкреслює належність таких атомів тому самому місцю в періодичній системі.
Відносна атомна маса елементів є середнім арифметичним мас ізотопів і з врахуванням їх поширення у природі.
Кількість нейтронів впливає тільки на масу атома. Найважливішою характеристикою атома є кількість протонів у ядрі (заряд ядра).
Для тих, хто хоче знати хімію глибше
1. Чи можуть до складу будь-якої молекули входити такі маси Оксигену:
а) 8 а.о.м;
б) 16 а.о.м;
в) 64 а.о.м;
г) 24 а.о.м?
Поясніть.
Відповідь: маса одного атома Оксигену дорівнює 16 а.о.м. Число атомів у молекулі може бути тільки цілим, тому:
а) 8 а.о.м. бути не може, тому що це відповідає 1/2 атома Оксигену.
б) 16 а.о.м. може бути, тому що це відповідає одному атому Оксигену.
в) 64 а.о.м. може бути, тому що це відповідає 4 атомам Оксигену.
г) 24 а.о.м. не може бути, тому що це відповідає 1,5 атома Оксигену.