Закон, як форма наукових знань
Основою пізнання – є експеримент. Англійський вчений XVII століття Роджер Бекон говорив: «Той, хто прагне відкриттів і твердого знання, а не здогадок і пророцтв, той хто не має наміру створювати ілюзорні світи у своїй уяві, але бажає випробовувати і досліджувати природу в її справжньому власному вигляді, має в усьому доходити істотних фактів».
Щоб дослідити природу вчені проводять продумані експерименти, різноманітні вимірювання і одержані чисельні співвідношення між виміряними величинами намагаються виразити математичними формулами. Це значить, що засобами математики і логічного мислення учені намагаються знайти в хаосі даних і фактів дещо правильне і закономірне, тобто відкрити науковий закон.
Закон піддають перевірці на багатьох об’єктах, шукають усе нові й нові випадки в практиці де цей закон проявляється. Якщо закон підтверджується знову і знову, його визнають правильним. Якщо якісь дослідження суперечать закону, закон змінюють. З розвитком науки закони змінюються, стають такими, що охоплюють дедалі більшу кількість явищ, даючи людям глибше і ширше розуміння природи. Хімічні закони дають змогу передбачити властивості речовин, перебіг хімічних реакцій, керувати хімічними перетвореннями.
Під час хімічних реакцій одні речовини перетворюються в інші. А чи відбуваються якісь зміни з масою речовин в результаті реакції? З цього приводу вчені висловлювали різні думки. Видатний англійський хімік Р. Бойль, прожарюючи у відкритій реторті різні метали і зважуючи їх до і після нагрівання, виявив, що маса металів збільшується. Ґрунтуючись на цих дослідах, він дійшов неправильного висновку, що маса речовини в результаті хімічних реакцій змінюється.
М. В. Ломоносов, на відміну від Р. Бойля, прожарював метали в запаяних ретортах і зважував їх до і після прожарювання. Він довів, що маса речовин до і після реакції залишається без змін. У 1748 році М. В. Ломоносов сформулював найважливіший закон хімії – закон збереження маси.
Такий же результат значно пізніше, не знаючи про дослідження Ломоносова, одержав французький учений А. Л. Лавуазьє, який сформулював закон збереження маси у 1789 р.
Сучасне формулювання закону збереження маси (інколи його ще називають законом Ломоносова-Лавуазьє) має вигляд:
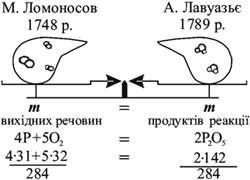
Отже, маса вихідних речовин (реагентів) дорівнює масі продуктів реакції. Якщо хімічну реакцію у загальному вигляді виразити схемою А + В = АВ, то закон збереження маси можна записати у такій формі: m(А + В) = m(АВ).
Закон збереження маси речовин можна пояснити так:
- Під час хімічних реакцій атоми не виникають з нічого і не зникають, а лише перегруповуються. Суть хімічної реакції полягає у перегрупуванні атомів.
- Загальна кількість атомів не змінюється.
- Загальна маса атомів залишається сталою до і після реакції.
Наприклад, під час взаємодії двохатомних молекул водню і хлору має утворитися стільки молекул хлороводню, щоб сумарна кількість атомів Гідрогену і Хлору в нових молекулах дорівнювала кількості цих атомів до реакції:
H2 + Cl2 = 2HCl
Оскільки, атоми мають сталу масу, не змінюється і маса речовини до і після реакції.
Чому в дослідах Бойля маса металів збільшувалась? Бо реакція проводилась у відкритому посуді, при цьому атоми металу сполучалися з молекулами кисню, що входить до складу повітря, і утворювалася нова речовина – оксид металу.
Спостерігаючи за горінням дров або вугілля, і порівнявши масу дров та масу утвореного попелу, можна подумати, що маса в результаті реакції зменшилась. Але, крім попелу, утворилось багато вуглекислого газу і водяної пари, які розсіялись у повітрі. Переконатися в тому, що маса речовин під час реакції не змінюється, можна на простому досліді. З цією метою скористаємося приладом, зображеним на рисунку.
В одне коліно двоколінної пробірки наллємо розчин купрум(ІІ) хлориду (CuCl2), а в інше – розчин лугу (NaOH). Перед проведенням хімічної реакції зрівноважимо прилад на технічних терезах. Нахиливши пробірку, змішаємо розчини. Одразу з’явиться блакитний осад.
Це свідчить про те, що між речовинами в розчинах відбулася хімічна реакція.
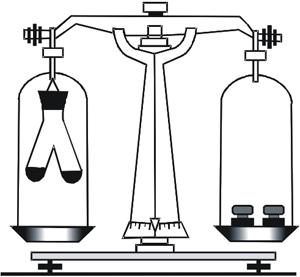
Рис. 64. Ілюстрування збереження маси під час перебігу хімічної реакції.
Проте рівновага терезів не порушилася, бо кількість атомів, а отже і їх загальна маса не змінилася.
Користуючись законом збереження маси, можна обчислити масу однієї з речовин, що вступила у реакцію, або однієї з утворених речовин, якщо відомі маси інших.
Приклад. Скільки грамів вуглекислого газу (CO2) виділилося в результаті розкладу малахіту (Cu2(OH)2CO3) масою 2,21 г, якщо при цьому утворився купрум оксид масою 1,59 г і вода масою 0,18 г?
|
Дано: |
m(CO2) = 2,21 – (1,59 + 0,18) = 0,44 (г). |
| m(CO2) – ? |
Відповідь: Під час розкладу малахіту масою 2,21 г виділиться вуглекислий газ масою 0,44 г.
На основі закону збереження маси речовини складають рівняння хімічних реакцій, можна пояснити суть коефіцієнт в рівнянні реакції.
Так на основі рівняння реакції 2Cu + O2 = 2CuO можна стверджувати:
- Якщо реагує два атоми Купруму і одна молекула кисню, утворюється дві молекули CuO.
- Якщо реагує 3 атоми Купруму і одна молекула кисню, утворюється дві молекули CuO а один атом Cu не прореагує. У такому випадку говорять, що мідь знаходиться в надлишку, щодо кисню, а кисень – у недостатності щодо міді.
Реагент, який знаходиться у нестачі, буде повністю витрачений у реакції.
Закон збереження маси речовин спостерігається лише в явищах, які відбуваються без руйнування атомів. Відкриття закону збереження маси речовин сприяло подальшому розвитку хімії як науки, організації хімічних виробництв, у яких виникає необхідність точно вирахувати масу сировини і кінцевих продуктів.
Підсумок
Суть закону збереження маси полягає ось у чому:
- маса речовин до реакції дорівнює масі речовин після реакції;
- він підтверджує, що речовини не зникають без сліду й утворюються з нічого;
- підтверджується висновок про те, що суть хімічних реакцій полягає в перегрупуванні атомів вихідних речовин й утворенні нових сполук;
- завдяки закону збереження маси можна складати рівняння реакцій і робити за ними розрахунки.
На цьому законі ґрунтується визначення коефіцієнтів у рівняннях хімічних реакцій. Кількість атомів кожного хімічного елемента у лівій та правій частині хімічних рівнянь повинно бути однаковим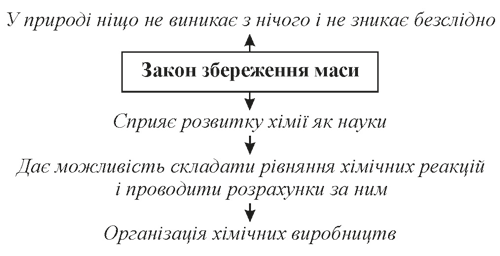
?
- Ким і коли був відкритий закон збереження маси речовин?
- Чому висновок Р. Бойля був помилковим?
- Чи правильно вважати, що під час горіння дров маса продуктів реакції зменшується?
- Яке значення відкриття закону збереження маси речовин?
- Чому маса купрум(ІІ) оксиду, утвореного при нагріванні малахіту, менша від маси малахіту, а маса купрум(ІІ) оксиду, утвореного при нагріванні міді, більша за масу взятої міді?


















