Досліджуючи гази, італійський учений А. Авогадро у 1811 р. висловив думку, яка пізніше підтвердилася численними дослідами і була сформульована у вигляді закону:
Нам відомо, що 1 моль будь-якої речовини містить 6,02 • 1023 структурних частинок (атомів, молекул, йонів). Рідкі й тверді речовини кількістю 1 моль, як видно із рис. 1, займають порівняно незначні й, до того ж, різні об’єми і мають різні маси.
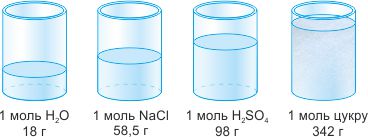
Рис. 1. Об’єм різних речовин кількістю 1 моль
У твердих і рідких речовин частинки зближені до стикання. Об’єм рідин і твердих речовин через це залежить головним чином від розмірів самих частинок. А в газах відстані між молекулами великі і значно більші від самих молекул (у 15-20 разів). Об’єм газу визначається головним чином відстанями між молекулами, а ці відстані за однакових умов (температури 0ºС і тиску 760 мм рт. ст.) в усіх газах приблизно однакові. Тому справедливим є і зворотне твердження, відоме як наслідок із закону Авогадро:
1 моль будь-якого газу за н. у. займає об’єм 22,4 л. Цей об’єм називають молярним об’ємом. Молярний об’єм чисельно дорівнює об’єму 1 моль речовини і позначається Vm («ве-ем»):
Vm = 22,4 л/моль, м3/моль.
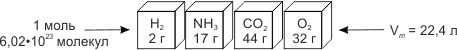
Оскільки число молекул однакове, вага рівних об’ємів газів пропорційна молекулярним масам узятих речовин.
Молярний об’єм газу (Vm) визначається за відношенням об’єму (V) порції даного газу до кількості речовини (n) в цій порції: Vm = V / υ, де V – об’єм газу за н. у., (л, м3); ν – кількість речовини газу, (моль).
Отже, молярний об’єм газу вимірюється в літрах на моль (л/моль) або кубічних метрах на моль (м3/моль).
Визначення молярного об’єму газу за кількістю речовини і об’ємом
Приклад 22. Обчисліть молярний об’єм газу, 3 моль якого займають об’єм 67,2 л.
|
Дано: υ(газу) = 3 моль |
Vm = V/ν; |
Розв’язання: Обчислюємо молярний об’єм газу: |
|
Vm(газу) – ? |
Відповідь: Vm(газу) = 22,4 л/моль.
Молярний об’єм газу можна обчислити також, знаючи молярну масу газу та його густину ρ, тобто масу 1 л даного газу за нормальних умов.
Визначення молярного об’єму газу за густиною
Приклад 23. Обчисліть молярний об’єм амоніаку (NH3), маса 1 л якого за нормальних умов важить 0,76 г.
|
Дано: ρ(NH3) = 0,76 г/л |
M(NH3) = 17 г/моль |
Розв’язання: Обчислюємо молярний об’єм амоніаку: |
|
Vm(NH3) – ? |
Відповідь: Vm(NH3) = 22,4 л/моль.
Знаючи молярний об’єм газів, можна визначити: а) об’єм газу за відомою кількістю речовини; б) кількість речовини газу за відомим об’ємом; в) масу 1 літра газу, виміряного за нормальних умов, за відомою молярною масою; г) об’єм газу за відомою густиною та масою:
|
V = υ • Vm |
υ = V / Vm |
m = M / 22,4 |
V = m / ρ |
Визначення об’єму газів
а) за кількістю речовини газу
Приклад 24. Обчисліть об’єм кисню кількістю речовини 2 моль.
|
Дано: n(O2) = 2 моль |
V = υ • Vm |
Розв’язання: Обчислюємо об’єм кисню кількістю речовини 2 моль: |
|
V(O2) – ? |
Відповідь: V(O2) = 44,8 л.
б) за масою газу
Приклад 25. Який об’єм займає карбон(IV) оксид масою 4,4 г?
|
Дано: m(СO2) = 4,4 г |
V = υ · Vm |
Розв’язання: 1. Визначаємо кількість речовини СО2: 2. Знаходимо об’єм СО2: |
|
V(СO2) – ? |
Відповідь: V(СO2) = 2,24 л.
в) за числом молекул
Приклад 26. Який об’єм за нормальних умов займуть 1,505·1023 молекул азоту?
|
Дано: N(N2) = 1,505•1023 |
V = υ • Vm; |
Розв’язання: 1. Визначаємо кількість речовини N2: 2. Знаходимо об’єм N2: |
|
V(N2) – ? |
Відповідь: V(N2) = 5,6 л.
Визначення кількості речовини газу за відомим об’ємом
Приклад 27. Яка кількість речовини карбон(IV) оксиду об’ємом 67,2 л?
|
Дано: V (СO2) = 67,2 л |
υ = V/Vm |
Розв’язання: 1. Визначаємо кількість речовини СО2: |
|
υ (СO2) – ? |
Відповідь: υ (СO2) = 3 моль.



















3 коментарі
Катя
вопрос. С какой это книги взято, а?
Ximiya
Матеріал авторський. Та й сутність закону Авогадро не залежить від джерела інформації про нього.
Манжелій Іван Олександрович.
Навіть в школі так гарно не пояснюють як тут, матеріалуне багато але й не мало, зате достатньо знань.