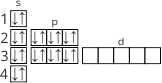Хімічний елемент характеризують, вказуючи його місце в періодичній системі, будову атома, тип елемента, характер оксиду й гідроксиду, можлива валентність, дають порівняльну характеристику.
За місцем у періодичній системі можна охарактеризувати будь-який хімічний елемент і одержати про нього такі дані:
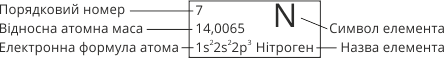
За положенням елемента в періодичній системі можна визначити будову його атома, родину елемента і його валентність, властивості простої речовини цього елемента та його сполук.
Користуючись періодичною системою елементів, дамо характеристику металічного елемента Кальцію.
|
Порядковий номер, заряд ядра, Аr |
20, +20, Аr =40 |
|
Місце в ПС |
Кальцій розміщений у 4-му періоді, II групі, головній підгрупі |
|
Будова атома |
Електронна оболонка складається з чотирьох шарів (4-й період), що містять 20 електронів. На зовнішньому енергетичному рівні знаходиться 2 електрони (номер групи). Електронна схема атома: |
|
Тип елемента, активність |
На зовнішньому енергетичному рівні атома Кальцію міститься 2 електрони, отже це металічний елемент, хімічно активний. Валентність його – II |
|
Летка сполука з Гідрогеном |
Леткої сполуки з Гідрогеном Кальцій не утворює |
|
Формула вищого оксиду, його характер |
Його вищий оксид CaO має оснóвні властивості: |
|
Гідроксид, що йому відповідає, його характер |
Йому відповідає гідроксид Ca(OH)2 |
|
Порівняння з властивостями елементів, що стоять поряд в періоді та підгрупі: |
Знаючи, як змінюються властивості елементів в межах груп і періодів, можемо порівняти Кальцій з елементами, що його оточують. Оскільки у атома Кальцію більший заряд ядра, ніж у Калію і менший, ніж у Скандію, то металічні властивості Кальцію слабкіші ніж Калію і сильніші ніж Скандію: K > Ca > Sc. Оскільки радіус атома Кальцію більший, ніж Магнію і менший ніж Стронцію, то металічні властивості у Кальцію сильніші ніж у Магнію, але слабкіші, ніж у Стронцію: Mg < Ca < Sr |
Характеристику неметалічного елемента розглянемо на прикладі Нітрогену
|
Порядковий номер елемента, його назва та відносна атомна маса: |
№ 7, Нітроген, Ar(N) = 14 |
|
№ періоду, ряду, групи, підгрупи: |
2 період, 2 ряд, V група, головна підгрупа |
|
Заряд ядра (кількість протонів), кількість нейтронів і електронів: |
7. ē = 7, p+ = 7, n0 = 7 |
|
Електронна формула: |
1s22s22p3 |
|
Електронна конфігурація атома: |
|
|
Валентність: |
ІІІ |
|
Активність: |
Неметалічний елемент, малоактивний |
|
Летка сполука з Гідрогеном: |
NH3 |
|
Формула вищого оксиду, його характер: |
N2O5 (кислотний) |
|
Гідратна сполука, що йому відповідає: |
HNO3 (кислота) |
|
Порівняння з властивостями елементів, що стоять поряд в періоді та підгрупі: |
Неметалічні властивості сильніше виражені ніж у Карбону та Фосфору, але слабкіше ніж у Оксигену |