Схема 3
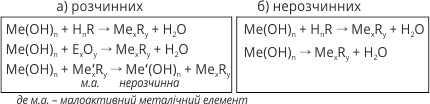
|
1. Розчинні і нерозчинні основи мають спільну властивість – реагують з кислотами, утворюючи сіль і воду: Під час взаємодії багатооснóвних кислот з гідроксидами можуть утворюватися кислі солі: Під час взаємодії багатокислотних гідроксидів з однооснóвними кислотами можуть утворюватися оснóвні солі: |
|
|
2. Луги реагують з кислотними оксидами, утворюючи середню або кислу сіль при надлишку чи нестачі лугу відповідно: |
Для нерозчинних основ такі реакції не характерні. |
|
3 Луги взаємодіють із розчинними солями малоактивних металічних елементів, утворюючи нову сіль і нерозчинну основу: Луги взаємодіють з кислими солями утворюючи середні солі: KHSO4 + KOH = K2SO4 + H2O. |
Для нерозчинних основ такі реакції не характерні. |
|
5. Майже всі основи (крім гідроксидів Натрію і Калію, лужних металів) у результаті нагрівання легко розкладаються на оксид і воду: |
|
Лабораторний дослід 3. Взаємодія лугів із кислотами в розчині
У пробірку з розчином лугу забарвленого фенолфталеїном добавте по краплях розчин хлоридної кислоти, поки не зникне забарвлення індикатора. Чому розчин знебарвився? Напишіть відповідне хімічне рівняння.
Лабораторний дослід 4. Взаємодія нерозчинних основ із кислотами
У пробірку з осадом купрум(II) гідроксиду повільно добавляйте розчин хлоридної кислоти до повного розчинення осаду. Якого кольору набуває речовина? Чому зник осад? Напишіть відповідне хімічне рівняння.
Лабораторний дослід 5. Термічне розкладання нерозчинних основ
Пробірку з осадом купрум(II) гідроксиду затисніть у пробіркотримачі. Вміст пробірки обережно нагрійте в полум’ї спиртівки. Як змінюється колір осаду? Чому змінився колір? Напишіть відповідне хімічне рівняння.
Схема 4
Способи добування основ
|
Розчинних |
Нерозчинних |
|
Meакт + H2O → MeOH + H2↑ |
(Meм.акт)хRy + МеOH = MexRy + Me(OH)n↓ |
|
Електроліз розчинів солей: 2NaCl + 2H2O = H2 + Cl2 + 2NaOH |
|
1. Розчинні гідроксиди (луги) можна добути взаємодією активних металів та їх оксидів з водою:
2Na + 2H2O = 2NaOH + H2↑;
Na2O + H2O = 2NaOH.
2. Взаємодією розчинів солей з лугами можна також використати для добування деяких розчинних основ. Якщо на розчини солей натрію, літію та деяких інших металів подіяти гідроксидом барію або кальцію, то внаслідок реакції утвориться розчинна основа і нерозчинна сіль, яку можна легко відокремити від розчину:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓;
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓.
3. Луги можна добути електролізом водних розчинів солей.
4. Нерозчинні гідроксиди можна добути реакцією обміну між сіллю (найчастіше сіллю малоактивного металічного елемента) та лугом у розчині:
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓.
Практичне застосування деяких основ
NaOH – у великій кількості використовується у нафтовій промисловості для очищення нафтопродуктів переробки нафти, в миловарній, паперовій, текстильній промисловостях, у виробництві штучного шовку та в ряді інших виробництв. Кип’ятінням деревини з NaOH добувають целюлозу. Обробка бавовняних тканин натрій гідроксидом поліпшує їх здатність до фарбування. Натрій гідроксид – важливий реактив у аналітичній хімії.
КОН – застосовують у миловарній промисловості для виготовлення рідкого мила. Внаслідок великої гігроскопічності його використовують як осушувач, для вбирання вуглекислого газу, у хірургії для припікання, як вихідний продукт для добування різних солей калію.
Ca(OH)2 – відомий під назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного вапна з піском і водою називають вапняним розчином і використовують для скріплення цегли під час мурування цегляних стін, а також як штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й утворення кальцій карбонату. Ca(OH)2 використовують для добування хлорного вапна [Са(ОН)2 + Сl2 → CaOCl2 + H2O]. Як «вапняну воду» застосовують для білення, у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами.
Ba(OH)2 – насичений водний розчин відомий як «баритова вода», є важливим лабораторним реактивом для виявлення СО2, йонів SO42– та СO32– та відносно дешевою розчинною основою.
NH4OH – один з найважливіших хімічних реактивів, розбавлений розчин якого «нашатирний спирт» застосовують як слабку основу в хімічній практиці, у медицині, домашньому господарстві.


















