Під час хімічних реакцій ядро атома не змінюється. Змін зазнають електронні оболонки атомів, особливостями будови яких пояснюються властивості хімічних елементів.
Крім обертання навколо ядра, електрон має ще свій власний рух – спін. Це рух електрона навколо своєї осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо своєї осі за годинниковою стрілкою, а інший – проти годинникової стрілки), то це – електрони з протилежними (антипаралельними) спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує взаємне притягання електронів. На одній орбіталі можуть перебувати лише два електрони з протилежними спінами. Схематично атомну орбіталь позначають квадратиком, а електрони стрілочками в двох протилежних напрямках ![]() .
.
Характеристика орбіталей
Електронна хмара може мати різну густину, розмір і форму. Чим сильніше притягується електрон до ядра, тим його хмара щільніша і менша за розміром. Електронна хмара може мати кілька форм. Електрон рухаючись навколо ядра, може утворювати хмару кулястої форми. Орбіталь, що має форму кулі називають s-орбіталлю, а електрон, що утворює таку форму орбіталі – s-електроном.
Орбіталі можуть мати форму гантелі (об’ємної вісімки) або ще складнішу. Орбіталі, що мають форму гантелі позначають буквою p, а електрони, які утворюють таку орбіталь називають p-електронами. Ці електрони розміщуються в просторі уздовж трьох взаємно перпендикулярних осей координат.
Будова електронних оболонок атомів
На кожному енергетичному рівні рухаються електрони з однаковою чи дуже близькою енергією. Першому рівню належать електрони, які перебувають найближче до ядра і тому мають найменшу енергію. Електрони другого рівня характеризуються вищою енергією, третього — ще вищою.
Енергетичні рівні позначають буквами K, L, M, N … або цифрами 1, 2, 3, 4 … і умовно позначають їх дужками ![]() (як частиною від кола) під час запису розміщення електронів на енергетичних рівнях.
(як частиною від кола) під час запису розміщення електронів на енергетичних рівнях.
На кожному енергетичному рівні рухається обмежене число електронів. Їх максимальне число на енергетичному рівні визначається за формулою:
N = 2n2, де n — номер рівня.
I рівень 2 × 12 = 2. III рівень 2 × 32 = 18.
II рівень 2 × 22 = 8. IV рівень 2 × 42 = 32.
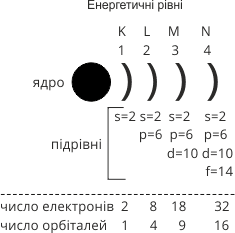
Схема 1. Розміщення електронів на енергетичних рівнях і підрівнях.
Якщо на орбіталі перебуває один електрон, то він називається неспареним, якщо два, то це – спарені електрони (орбіталь умовно позначають квадратиком, а електрони – стрілками в протилежних напрямках).
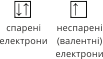 |
Якщо зовнішній електронний шар атома має максимальне число електронів, яке він може вмістити, то такий шар називають завершеним. Якщо в зовнішньому електронному шарі атома міститься менше електронів, ніж він може вмістити, то цей шар називають незавершеним. |
На останньому енергетичному рівні будь-якого атома не може бути більше 8 електронів.
Електронна будова атома Сульфуру
Електронна схема – це розподіл електронів в атомі на енергетичних рівнях.
Для написання електронної схеми необхідно:
|
1. |
За порядковим номером елемента визначаємо число протонів у ядрі, і число електронів, вказуємо символ елемента. |
|
|
2. |
Номер періода вказує на число енергетичних рівнів (пишемо число дужок). |
|
|
3. |
Номер групи елемента вказує на число електронів на зовнішньому енергетичному рівні. |
|
|
4. |
Пишемо максимальне число електронів, на першому енергетичному рівні (2), а другий розраховуємо за різницею: 16 – 6 – 2 = 8. (Якщо рівнів більше, то чинимо так: пишемо число електронів за номером групи під останнім рівнем, під першими рівнями — максимальну їх кількість для цих рівнів, а під передостаннім — залишок). |
|
Електронна формула — це розподіл електронів в атомі на енергетичних рівнях і підрівнях.
|
1. |
16 електронів у атомі Сульфуру знаходяться на трьох енергетичних рівнях. На першому рівні (1) рухається два s-електрони (число електронів пишеться вгорі справа). |
1s2 |
|
2. |
На другому енергетичному рівні (2) рухаються два s-електрони і шість p-електронів (номер рівня пишеться для кожного підрівня). |
2s2 2p6 |
|
3. |
На третьому енергетичному рівні (3) рухаються два s-електрони і чотири p-електрони. |
3s2 3p4 |
|
4. |
Сумарна електронна формула матиме вигляд: |
1s22s22p63s23p4 |
Електронна конфігурація — це графічне зображення розподілу електронів на енергетичних рівнях і підрівнях. Електрони позначаються стрілочками, а орбіталі — клітинками. Вільна клітинка — це вільна орбіталь, яку може зайняти електрон після збудження.
Орбіталі заповнюють так:
|
1. |
Перший енергетичний рівень має тільки один s–підрівень, на якому знаходяться два електрони з протилежними спінами. |
|
|
2. |
Другий енергетичний рівень має два підрівні: на s-підрівні знаходиться 2 електрони і на p-підрівні — 6 (на трьох орбіталях). |
|
|
3. |
Третій енергетичний рівень має три підрівні: на s-підрівні знаходиться 2 електрони, на p-підрівні — 4 (на трьох орбіталях), а d-підрівень (п’ять орбіталей) у Сульфуру не заповнений. |
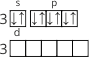 |
В такому, незбудженому, стані атом Сульфуру має два неспарені електрони – тобто проявляє валентність II.
На третьому d-підрівні є вільні орбіталі, тому в збудженому стані електрони з 3p-підрівня та 3s-підрівня можуть «перестрибувати» на 3d-підрівень, займаючи вільні орбіталі. Валентність атома при цьому змінюється на ІV або VІ.
Розміщуючи електрони по електронних (квантових) комірках, можна виявити число неспарених електронів в атомі і можливу валентність елемента.
Під дією зовнішньої енергії, електрон може «перестрибнути» з нижнього підрівня на більш високий підрівень в межах одного енергетичного рівня. Такий стан атома називають збудженням.
В межах одного періоду у елементів головних підгруп поступово збільшується число електронів на останньому, а у елементів побічних підгруп — на передостанньому енергетичному рівні.
Щоб розрахувати число неспарених електронів у елементів IV-VII груп головних підгруп, необхідно від числа 8 відняти номер групи.


















