Для позначення виду атомів з певним зарядом ядра і масовим числом використовують термін – нуклід. Ядро (латинське «nucleus» — «ядро»). – нуклід.

|
Протон — це позитивно заряджена частинка з зарядом +1 і з масою, що дорівнює масі атома Гідрогену, тобто 1.Таким чином, протони являють собою ядра атомів Гідрогену. Число протонів збігається з порядковим номером елемента в періодичній таблиці елементів. Д.І. Менделєєва. Тому порядковий номер елемента ще називають протонним числом. Найважливішою характеристикою атома є кількість протонів у ядрі (заряд ядра). |
Нейтрон — це частинка з масою 1, але позбавлена заряду. Нейтрони — електронейтральні частинки, тому вони не впливають на заряд ядра, а тільки на його масу. |
|
Кожна з цих частинок має певну масу. Маси протонів і нейтронів майже однакові (mпротона= 1.0073, mнейтрона= 1.0086 в а.о.м.). Елементарні частинки ядра утримуються так званими ядерними силами. |
|
Електронна оболонка
|
Навколо ядра обертаються зовсім маленькі частинки – електрони. Електрони розміщуються на різних відстанях від ядра формуючи електронні шари, або рівні, число яких співпадає із номером періода і утворюють негативно заряджену електронну оболонку атома. Електрони – це негативно заряджені частинки із зарядом -1 (в одиницях вимірювання заряду елементарних частинок). Маса електрона у 1840 разів менша маси протона (me–= 0,00055). Електрони утримуються в атомі за рахунок притягування до позитивно зарядженого ядра, проте електрони не падають на ядро, тому що вони рухаються зі значною швидкістю у межах стаціонарних орбіт. Маса електрона дуже маленька, тому можна вважати що вся маса атома сконцентрована в ядрі. Однак, радіус ядра атома в десятки разів менший за радіус атома з електронами, розміщеними в електронному шарі. Для уявлення про співвідношення величин атомних структур: якщо атом збільшити до розмірів стадіону, то ядро буде завбільшки з вишневу кісточку |
Число протонів в атомі дорівнює числу електронів, тому атом в цілому електронейтральний.
Маси протона і нейтрона приблизно однакові. В ядрі зосереджена майже вся маса атома. Кількість протонів N(p+) у ядрі і кількість електронів N(ē) дорівнює порядковому номеру елемента (Z):
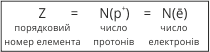
Оскільки маса протона і маса нейтрона рівна 1, а число протонів відповідає порядковому номеру елемента, то знаючи відносну масу атома, легко розрахувати число нейтронів:
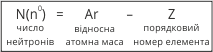
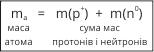
Розглянемо будову атома Натрію.
|
Порядковий номер цього хімічного елемента – 11. Значить у ядрі атома є 11 протонів, а навколо ядра рухається 11 електронів. Відносна маса протона дорівнює 1, значить маса всіх протонів – 11. Нехтуючи масою 11електронів, знайдемо число нейтронів, знаючи, що відносна атомна маса натрію дорівнює приблизно 23: N(n0) = Ar(Na) – Z(Na) = 23 – 11 = 12. |
Електрони утримуються в атомі за рахунок притягування до позитивно зарядженого ядра, проте електрони не падають на ядро, тому що вони рухаються зі значною швидкістю у межах стаціонарних орбіт.
Ядра з великим числом протонів (більше 83) є нестабільними, для них характерний радіоактивний розпад. Нестійкість великих ядер є причиною того, що в природі немає елементів з порядковим номером більшим за 92. Атоми цих елементів добувають в лабораторних умовах.


















