Якщо атоми елементів, які взаємодіють між собою, дуже відрізняються за своєю електронегативністю, то спільна електронна пара, яка утворює зв’язок, настільки зміщується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Найпростішими за складом є йонні сполуки, утворені двома елементами (бінарні сполуки), в яких один елемент металічний, а інший – неметалічний. Атоми металічних елементів здатні лише віддавати електрони, а атоми неметалічних елементів – притягувати їх.
Неметалічний елемент буде притягувати стільки електронів скільки йому необхідно для завершення зовнішнього енергетичного рівня до октета. Розглянемо механізм утворення йонного зв’язку на прикладі натрій фториду.
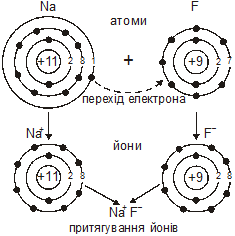
При взаємодії атомів Натрію з атомами Флуору валентний електрон Натрію повністю переходить на зовнішній електронний шар атома Флуору, добудовуючи його до октету. При цьому атом Флуору набуває негативного заряду, перетворюючись з нейтрального атома на негативно заряджений йон. Атом Натрію, втративши один електрон, набуває позитивного заряду +1, перетворившись з нейтрального атома на позитивно заряджений йон.
![]()
Різнойменно заряджені Йони Na+ і F–, притягуючись один до одного завдяки силам електростатичного притягання, утворюють сполуку NaF.
Величина негативного заряду атома дорівнює числу приєднаних електронів, а величина позитивного заряду — числу відданих електронів. Сполуки, в яких існує йонний зв’язок, називають йонними.
Йонний зв’язок здійснюється за рахунок електростатичного притягання йонів, утворених в результаті значного зміщення електронів у сторону одного з елементів.
Йонний зв’язок найбільш характерний для сполук утворених типовим металічним і типовим неметалічним зв’язком. Він характерний і для твердих гідроксидів найбільш типових металічних елементів (KOH, NaOH, RbOH, CrOH), які містять позитивно заряджені йони металічного елементу і негативно заряджені гідроксид-іони OH–. До йонних сполук належать багато солей оксигеновмісних кислот. Наприклад, кристали NaNO3 складаються з позитивних йонів Na+ і негативних .
У складних молекулах часто поєднуються різні типи хімічного зв’язку. Якщо зобразити структурну формулу натрій нітрату, то з цієї формули видно, що атом Натрію сполучається з атомом Оксигену йонним зв’язком, а атом Нітрогену з атомами Оксигену — ковалентним полярним зв’язком.
Єдність ковалентного і йонного зв’язків полягає у тому, що в утворенні кожного з них приймають участь електрони атомів, які взаємодіють між собою. Фізичні властивості речовин залежать від типу хімічного зв’язку. Узагальнити знання про хімічний зв’язок можна за допомогою схеми.


















