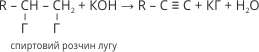Ацетиленові вуглеводні (алкіни)
Ацетилен, молекулярна формула якого – С2Н2 має найбільше значення серед вуглеводнів з одним потрійним зв’язком.
CnH2n–2 –ин, –ін.
Будова молекули ацетилену
Якщо навколо двох атомів Карбону розмістити два атоми Гідрогену, то структурну формулу ацетилену треба було б зобразити так:
![]()
Однак вільних зв’язків не повинно бути, а тому між атомами Карбону утворюються два нові зв’язки:
Н – С ≡ С – Н
Н–С≡С–Н, ацетилен
Фізичними методами дослідження встановлено, що молекула ацетилену має лінійну будову, в ній всі чотири атоми розміщені на одній прямій. Атоми Карбону, що утворюють потрійний зв’язок перебувають у стані sp-гібридизації. Це означає, що в гібридизації беруть участь одна s- і одна р-орбіталі. При цьому кожний атом Карбону утворює дві гібридні орбіталі, які максимально віддалені одна від одної (кут 180°). Одна із sp-гібридних орбіталей приймає участь в утворенні σ-зв’язку С–Н, а друга – на утворення σ-зв’язку С–С. Дві негібридизовані π-орбіталі кожного атома Карбону, що зберегли форму симетричних гантелей, розміщені одна відносно одної під кутом 90°. При бічному перекриванні з подібними орбіталями другого атома Карбону вони утворюють два π-зв’язки, розміщені у двох взаємно перпендикулярних площинах.
Структурна формула
Електронна формула
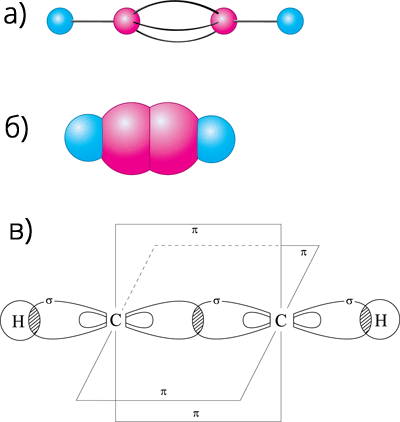
Рис. 52. а) Кулестержнева; б) масштабна модель ацетилену; в) схема утворення σ-зв’язків і π-зв’язків у молекулі ацетилену.
Таблиця 11. Гомологічний ряд ацетиленових вуглеводнів
|
Молекулярна формула |
Напівструктурна формула |
Назва |
Температура кипіння (°С) |
|
С2Н2 |
Н – С ≡ С – Н |
Ацетилен (етин) |
–83,8 |
|
C3H4 |
СН3 – С ≡ С – Н |
Пропін |
–23,3 |
|
C4H6 |
СН3 – СН2 – С ≡ СН |
1 – Бутин |
+8,5 |
С2… С4 – гази; С5… С15 – рідини; С16… тверді речовини.
Фізичні властивості
Ацетилен – безбарвний газ, Mr = 26, легший від повітря, малорозчинний у воді, в чистому вигляді майже без запаху.
Подумай! Чому ацетилен горить кіптявим полум’ям?
Хімічні властивості
1. На повітрі ацетилен горить кіптявим полум’ям. Суміш ацетилену з повітрям чи з киснем вибухонебезпечна.
Ацетилен є ненасиченою сполукою, тому для нього характерні реакції приєднання. Реакції приєднання ацетилену проходять у дві стадії: спочатку потрійний зв’язок переходить у подвійний, а потім подвійний – в одинарний.
2. Ацетилен взаємодіє з галогенами. Він знебарвлює бромну воду. Приєднання галогенів відбувається дуже енергійно.
Наприклад:
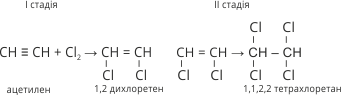
Щоб пересвідчитися у тому, що ацетилен – сполука ненасичена, в циліндр, заповнений газом, наллємо розчин калій перманганату. Розчин швидко знебарвиться.
3. При підвищеній температурі (в присутності каталізатора нікеля або платини) ацетилен приєднує водень.
СН ≡ СН (ацетилен) + Н2 → СН2 = СН2 (етилен)
СН2 = СН2 (етилен) + Н2 → СН3–СН3 (етан)
4. Ацетилен приєднує хлороводень з утворенням вінілхлориду. Суміш газів, що складається з ацетилену та гідроген хлориду нагріту до 120-180°С, пропускають через активоване вугілля, насичене сулемою (HgCI2):
СН ≡ СН (ацетилен) + НCl → СН2 = СНCl (вінілхлорид)
Вінілхлорид застосовують для одержання поліхлорвінілу.
5. У присутності меркурій сульфату ацетилен приєднує воду з утворенням оцтового альдегіду (реакція Кучерова):
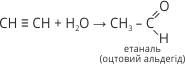
 Михайло Григорович Кучеров (1850 – 1911 р.р.), російський хімік. Відкрив реакцію гідратації ацетилену.
Михайло Григорович Кучеров (1850 – 1911 р.р.), російський хімік. Відкрив реакцію гідратації ацетилену.
6. Ацетилен може полімеризуватись (тримеризуватись) утворюючи бензен:
3С2Н2 → С6Н6
7. Під впливом потрійного зв’язку атоми Гідрогену в молекулі ацетилену стають доволі рухомими й легко заміщуються на атоми металічних елементів з утворенням похідних ацетилену-ацетиленідів. Пропускаючи ацетилен крізь аміачний розчин аргентум оксиду можна добути осад білого кольору аргентум ацетиленіду:
СН ≡ СН + Ag2O → Ag–C ≡ C–Ag (аргентум ацетиленід) + H2O.
Властивості ацетилену можна зобразити схемою, поданою нижче.
Схема 9. Хімічні властивості
Застосування ацетиленових вуглеводнів
- Газове зварювання й різання металів.
- Як сировина для виробництва розчинників (галогенпохідні), пластмас й синтетичного каучуку, оцтової кислоти, етанолу, ізоляційних матеріалів, люїзиту (отруйна речовина шкірно-наривної дії). Хлорпохідні, одержувані з ацетилену, являють собою чудові розчинники жирів та сірки.
Підсумок
- Валентний кут = 180°.
Будова молекули ацетилену – лінійна.
Довжина С–С зв’язку – 0,12 нм.
Зв’язки – два σ і два π (кожного атома Карбону за місцем потрійного зв’язку). - Ацетилен, як й етилен, легко окиснюється. Він знебарвлює розчин калій перманганату та бромної води.
- Ацетилен горить сильно кіптявим полум’ям тому, що містить 92% Карбону. При внесенні в полум’я ацетилену достатню кількість повітря, полум’я світиться яскраво-білим світлом; температура полум’я досягає до 1900°С. В ацетилено-кисневому полум’ї температура досягає до 3000°С.
- Для ацетилену, як й для етилену, характерні реакції приєднання.
- На відміну від етилену, який з водою утворює спирт, ацетилен з водою утворює альдегід.
?
- У чому суть sp-гібридизації?
- Які реакції називаються реакціями полімеризації? Напишіть рівняння реакції полімеризації пропілену.
- Чи існують у природі етилен й ацетилен? Дайте обґрунтовану відповідь.
Для тих, хто хоче знати більше
Таблиця 12. Методи добування ацетиленових вуглеводнів
|
Промислові |
Лабораторні |
|
1. Піроліз нафтопродуктів. |
1. З дигалогенпохідних насичених вуглеводнів: |
|
2. З кальцій карбіду: |
|
|
3. Піроліз метану: |