Крім розглянутих нами оксигеновмісних органічних сполук є велика кількість сполук, які містять крім Карбону, Гідрогену й Оксигену елемент – Нітроген. Серед них велике значення для життєдіяльності людини й тварин мають амінокислоти та білки.
Амінокислота
R – COOH
ﺍ
NH2
Загальна формула амінокислот: ![]()
Амінокислоти можна розглядати як похідні карбонових кислот, які утворюються заміщенням одного або кількох атомів Гідрогену вуглеводневого радикалу на аміногрупу. Якщо в молекулі оцтової кислоти CH3COOH один атом Гідрогену замістити на аміногрупу, утвориться амінооцтова кислота:
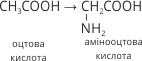
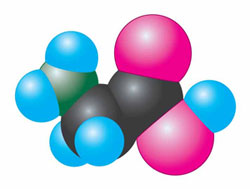
Рис. 65. Модель молекули амінооцтової кислоти
Грецький алфавіт:
α – альфа
β – бета
γ – гама
δ–дельта
ε – епсилон
Амінокислоти часто називають за назвою відповідної карбонової кислоти, до якої додають слово аміно. Положення аміногрупи відносно карбоксильної позначають грецькими буквами α, β, γ тощо. Номерація починається від першого атома Карбону за карбоксильною групою. Група COOH завжди пишеться на кінці молекули, місце аміногруп може змінюватися. Наприклад:
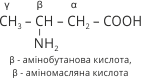
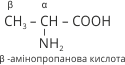
Для амінокислот, які входять до складу білків збереглися історичні (тривіальні) назви: амінооцтова кислота – гліцин, α – амінопропанова кислота – аланін.
![]()
Фізичні властивості
Амінокислоти – тверді, безбарвні, кристалічні речовини, більшість з яких добре розчинні у воді. Багато з них солодкі на смак. При температурі вище +250°С плавляться (з розкладанням). Відомо близько 200 амінокислот, з них в людському організмі їх міститься понад 60, а в складі білків тіла людини їх – 22.
Амінооцтова кислота – найпростіша з амінокислот. Водний розчин цієї амінокислоти має нейтральну реакцію, оскільки у кислоті міститься одна аміногрупа, яка проявляє лужні властивості й одна карбоксильна група, яка проявляє кислотні властивості. Серед амінокислот існують такі, що містять дві аміногрупи й проявляють слаболужну реакцію, або дві карбоксильні групи, та проявляють слабо кислу реакцію й діють на індикатори. Середовище кислот залежить від того, які функціональні групи у них переважають.
Хімічні властивості
За хімічними властивостями амінокислоти – своєрідні органічні амфотерні сполуки. Оскільки в молекулах амінокислот містяться протилежні за своїм характером функціональні групи, ці речовини виявляють властивості основ й кислот. Індикатор у розчині виявляє нейтральну реакцію: відбувається нібито взаємна нейтралізація протилежних за властивостями функціональних груп.
Амінокислоти реагують з мінеральними кислотами з утворенням солей, проявляючи властивості основ. Наприклад:
1. При взаємодії з одноосновною хлоридною кислотою утворюється середня сіль:
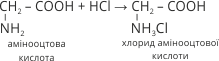
2. При взаємодії з двоосновною сульфатною кислотою утворюється кисла сіль:
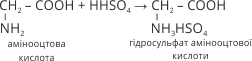
3. При надлишку амінокислоти з багатоосновною мінеральною кислотою може утворитися середня сіль:
![]()
4. Амінокислоти, як й карбонові кислоти, реагують з оксидами, гідроксидами й солями слабких кислот з утворенням солей:
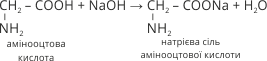
5. Амінокислоти, як й карбонові кислоти, реагують із спиртами з утворенням естерів:
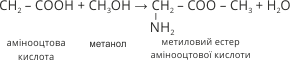
6. Найважливішою властивістю амінокислот є взаємодія їх молекул між собою, яка відбувається за рахунок різних за характером функціональних груп. Унаслідок реакцій утворюються ди–, три–, поліпептиди й виділяється вода:
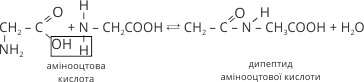
Група атомів –C–N–, яка сполучає окремі ланки ланцюга в такій молекулі, називається пептидною або амідною, а зв’язок між атомами Карбону й Нітрогену – пептидний або амідний. Такий зв’язок характерний лише для білків.
Утворений дипептид може реагувати з третьою молекулою амінокислоти з утворенням трипептиду й т. д. Утворена молекула побудована із залишків амінокислот називається поліпептидом. Утворення поліпептидів відбувається за типом реакції поліконденсації, причому в реакцію можуть вступати як однакові так й різні амінокислоти.
Реакції поліконденсації – це реакції, в результаті яких крім високомолекулярної речовини утворюється побічний низькомолекулярний продукт, наприклад, вода.
Схема 18. Хімічні властивості амінокислот
Амінокислоти утворюються під час гідролізу білків, як кінцеві продукти гідролізу.
Значення амінокислот
1. Із амінокислот в організмі синтезуються білки органів й тканин, гормони, ферменти та інші біологічно важливі речовини. Амінокислоти використовують як лікувальні засоби при деяких захворюваннях: метіонін – при церозі печінки, після операції на серці, при інфаркті; лізин – харчування для недоношених дітей, для підгодівлі тварин у сільському господарстві; глютамінова кислота – при епілепсії.
2. Для виробництва синтетичних волокон, наприклад, капрону й енанту.
Підсумок:
- Амінокислоти – це амфотерні органічні сполуки, в молекулах яких міститься одночасно аміногрупа NH2 й карбоксильна група – COOH.
- Амінокислоти є амфотерними сполуками й здатні утворювати солі як з кислотами, так з основами.
- Маючи амфотерні властивості, молекули амінокислот здатні реагувати одна з одною утворюючи поліпептиди.
- Поліпептиди характеризуються наявністю зв’язку -NH-СО- , який називається пептидним зв’язком.
- Амінокислоти, які синтезуються в організмі тварин й людини, називають замінні. Амінокислоти, які не синтезуються в організмі, а надходять з їжею, називають незамінні.
?
- Дати визначення амінокислот.
- Які функціональні групи входять до складу амінокислот?
- Що таке пептидний зв’язок, як він утворений?
- Які реакції належать до реакцій поліконденсації?
- Чому амінокислоти є амфотерними сполуками?
- Чому амінокислоти відносять до амфотерних сполук?
- Яке значення амінокислот?
Для допитливих
♦ Російський учений-біохімік О. Я. Данилевський на основі своїх досліджень у 1888 році вперше висловив гіпотезу про пептидний зв’язок між залишками амінокислот у білковій молекулі. Пізніше на початку ХХ століття німецький учений Е. Фішер експериментально підтвердив існування такого зв’язку. Йому вдалося синтезувати поліпептид, який складався з 19 залишків амінокислот.
♦ Доведено що не менше 14 захворювань виникають через порушення амінокислотного обміну, з яких 12 виражаються у психічних розладах. Більшість з них лікують за допомогою амінокислотних дієт й вітамінотерапії. Наприклад, при спадковому порушенні обміну фенілаланіну й терозину у 60% дітей відмічають ідіотію, а у 10% – слабо виражену олігофренію. З цим порушенням зв’язане й явище альбінізму (лат. albus – «білий»).
Для тих, хто хоче знати більше
Способи добування амінокислот
1. Гідроліз білка (добувають суміш амінокислот).
2. Дія галогенів (CI2, Br2 – умовно Г2) на карбонові кислоти.Утворені галогенопохідні кислоти взаємодіють з амоніаком з утворенням амінокислот. Реакція відбувається за схемою:
1) R–COOH +Г2 → RГ–COOH + НГ;
2) RГ–COOH + NH3 → RNH2–COOH + НГ.
Наприклад:
1) СН3–COOH (оцтова кислота) + CI2 → СН2CI–COOH (хлороцтова кислота) + НCI;
2) СН2CI–COOH (хлороцтова кислота) + NH3 → СН2NH2–COOH (амінооцтова кислота) + НCI.

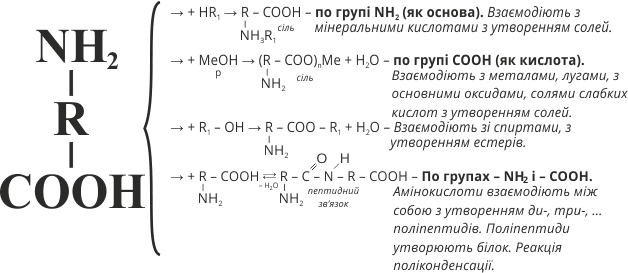


















3 коментарі
Соломія
Дякую вам, дуже корисна інформація, ви мені дуже допомогли
Мія
Унаслідок реакцій утворюються ди–, три–, …
де це написано?
Софія
большое, Вам, спасибо за эту информацию! она оказалась очень полезной для меня
спасибо :>