Дисоціація кислот
Більшість кислот добре розчиняються у воді. З відомих вам кислот тільки силікатна кислота у ній не розчиняється. Розчини кислот змінюють колір індикаторів: лакмусу – на червоний, метилового оранжевого – на рожевий.
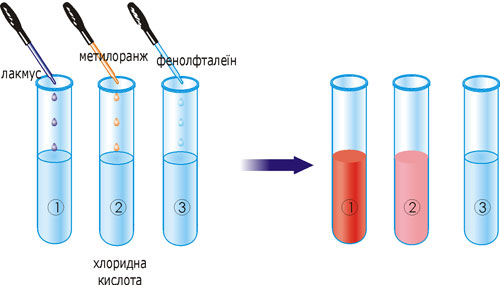
Рис. 24. Зміна кольору індикаторів у розчині хлоридної кислоти.
Цю властивість кислот використовують для розпізнавання їх серед інших речовин. Чому розчинні у воді кислоти проявляють такі властивості? Розглянемо процес дисоціації кислот. Процес дисоціації кислот, наприклад, нітратної, сульфатної і фосфатної кислот, слід зобразити так:
HNO3 ⇄ H+ + NO3–.
H2SO4 ⇄ 2H+ + SO42–
H3PO4 ⇄ 3H+ + РO43–
В процесі дисоціації утворюються позитивні йони Гідрогену і негативні йони кислотного залишку: нітрат-іон NO3–, сульфат-іон SO42– і фосфат-іон РO43–. Спільним для всіх кислот є наявність йонів Гідрогену. Саме H+ надає кислотам характерних для них загальних хімічних властивостей, змінює колір індикаторів. Знак «оберненості» (⇄) показує одночасний перебіг двох процесів-прямого (зліва направо), тобто дисоціацію, і зворотного (справа на ліво) – асоціацію.
Усі розчинні кислоти у водних розчинах дисоціюють на гідроген-іони H+ і кислотні залишки.
Процес дисоціації кислот можна зобразити такою схемою:
HnR ⇄ nH+ + Rn–, де R – кислотний залишок, n – число атомів Гідрогену.
Багатоосновні кислоти дисоціюють ступінчасто. Наприклад:
| III HR2– ⇄ H+ + R3–
II HR2– ⇄ H+ + R3– I HR2– ⇄ H+ + R3–
|
H3PO4 ⇄ H+ + H2PO4– дигідрогенфосфат-іон H3PO4– ⇄ H+ + HPO42– гідрогенфосфат-іон H3PO42– ⇄ H+ + PO43– фосфат-іон H3PO4 ⇄ 3H+ + PO43– |
Дисоціація основ
Розчини основ (луги) змінюють колір індикаторів: лакмусу – на синій, метилового оранжевого – на жовтий, фенолфталеїну – на малиновий:
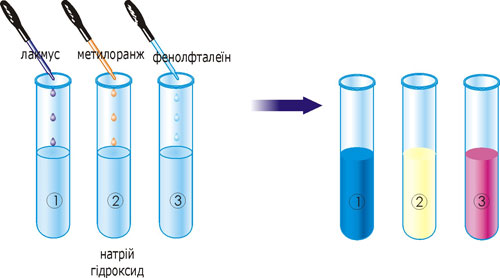
Рис. 25. Зміна кольору індикаторів у розчині лугу.
Цю властивість основ використовують для розпізнавання їх серед інших речовин. Чому розчинні у воді основи проявляють такі властивості? Розглянемо процес дисоціації натрій гідроксиду і калій гідроксиду:
NaOH ⇄ Na+ + OH–
КOH ⇄ К+ + OH–
В процесі дисоціації утворюються позитивні йони Натрію і Калію і негативні гідроксид-іони. Спільним для всіх розчинних основ є наявність гідроксид-іонів. Саме ОH– надає основам характерні для них загальні хімічні властивості, змінює колір індикаторів. Луги дисоціюють на позитивно заряджені катіони металічних елементів і негативно заряджені гідроксид-іони.
Процес дисоціації основ можна зобразити такою схемою:
MeOH ⇄ Men+ + nOH–, де n – валентність металічного елемента.
Якщо гідроксид містить в молекулі декілька груп OH–, то може відбутися ступінчаста дисоціація. Наприклад:
Ba(OH)2 ⇄ Ba(OH)+ + OH– (I ступінь)
Ba(OH)+⇄ Ba2+ + OH– (II ступінь).
Ba(OH)2 ⇄ Ba2+ + 2OH– сумарне рівняння
Спочатку відщеплюється один гідроксид-іон, а наступні OH– – в сильно розбавлених розчинах.
Лабораторний дослід 1. Виявлення йонів Гідрогену і гідроксид-іонів в розчині
Дослід 1. Виявлення йонів Гідрогену в розчині.
У три пробірки з хлоридною кислотою долийте по 1–2 краплі індикатора: в першу – лакмусу, в другу – метилового оранжевого, у третю – фенолфталеїну. Що спостерігається? Яким індикатором не можна виявити іонів водню? Чому? Який висновок можна зробити про дію кислот на індикатори?
Дослід 2. Вивчення гідроксид-іонів в розчині.
У три пробірки з натрій гідроксидом долийте по 1–2 краплі індикатора: в першу – лакмусу, в другу – метилового оранжевого, в третю – фенолфталеїну. Що спостерігаєте? Який можна зробити загальний висновок про дію лугів на індикатори? Заповніть таблицю:
|
Індикатори |
Колір індикатора в середовищі |
||
|
нейтральному |
кислому |
лужному |
|
|
лакмус метилоранж фенолфталеїн |
|||
Чим зумовлюються загальні властивості кислот і лугів?
Дисоціація солей
Розрізняють такі солі: середні, кислі і основні.
Середні солі – продукти повного заміщення атомів Гідрогену в молекулі кислоти на йони металічного елемента. Процес дисоціації середніх солей можна зобразити такою схемою:
MexRy ⇄ xMen+ + yRn–, де х – число атомів металічного елемента, у – число кислотних залишків, n – валентність металічного елемента.
Наприклад: NaCl ⇄ Na+ + Cl–
Al2(SO4)3 ⇄ 2Al3+ + 3SO42–
Середні солі – це електроліти, які у водних розчинах дисоціюють на катіони металічних елементів і аніони кислотних залишків.
Розчини солей не мають спільних властивостей, тому що не мають спільних йонів.
Підсумок :
- Продуктами дисоціації кислот є катіони Гідрогену та аніони кислотних залишків.
- У розчинах солей містяться катіони металічних елементів, та аніони кислотних залишків.
- У розчинах лугів містяться катіони металічних елементів, та аніони ОН–.
- Дисоціюють тільки розчинні у воді сполуки. Нерозчинні основи, як Zn(OH)2, Al(OH)3 та інші; кислота – H2SіO3, нерозчинні солі – ZnS, AgCl, BaSO4. Оксиди не дисоціюють.
- Сильні електроліти дисоціюють повністю (одна ступінь), слабкі – ступінчасто.
?
- Що таке електролітична дисоціація?
- Дайте визначення кислот, лугів, солей з точки зору електролітичної дисоціації?
- Чим дисоціація кислих солей відрізняється від дисоціації середніх солей?
- Наявність яких йонів обумовлює кислотні й лужні властивості розчинів?
- Чому розчини солей не мають спільних властивостей?
Для тих, хто хоче знати більше
Кислі солі – продукти неповного заміщення атомів Гідрогену в молекулі кислоти на йони металічного елемента.
Процес дисоціації кислих солей можна зобразити такою схемою:
MeHR ⇄ Men+ + HRn–; HRn– ⇄ H+ + Rn–
Дисоціація кислих солей відбувається ступінчасто. Наприклад:
а) дисоціація калій гідрогенсульфату:
KHSO4 ⇄ K+ + HSO4– (I ступінь)
HSO4– ⇄ H+ + SO42– (II ступінь)
б) дисоціація кальцій дигідрогенфосфату:
Ca(H2PO4)2 ⇄ Ca2+ + 2H2PO4– (I ступінь)
H2PO4– ⇄ H+ + HPO42– (II ступінь)
HPO42– ⇄ H+ + PO43– (III ступінь)
Дисоціація на II і III ступенях дуже мала, тому розчин кислої солі містить лише незначну кількість гідроген-йонів.
Основні солі – продукти неповного заміщення гідроксид-іонів в молекулах багатоосновних гідроксидів на аніони кислотних залишків.
Заряд катіону рівний сумі зарядів аніону з протилежним знаком.
Процес дисоціації основних солей можна зобразити такою схемою:
MeOHR ⇄ MeOHn+ + Rn–
Наприклад:
магній гідроксихлорид MgOHCl ⇄ MgOH+ + Cl–
ферум дигідроксихлорид Fe(OH)2Cl ⇄ Fe(OH)2+ + Cl–
алюміній гідроксихлорид Al(OH)Cl2 ⇄ AlOH2+ + 2Cl–
Дисоціація катіону на йон металічного елементу і OH– майже не відбувається.


















