Розчини кислот, лугів і солей у воді
На межі XVIII-XIX століть, для дослідження властивостей речовини почали застосовувати електричний струм й звернули увагу на те, що одні речовини, перебуваючи у водному розчині, проводять електричний струм, а інші – не проводять. Речовини, які проводять струм у водному розчині або розплаві не проводять його в сухому вигляді.
Якщо занурити електроди в суху кухонну сіль, замкнути електричне коло, як показано на рисунку 21, то лампочка не засвітиться.
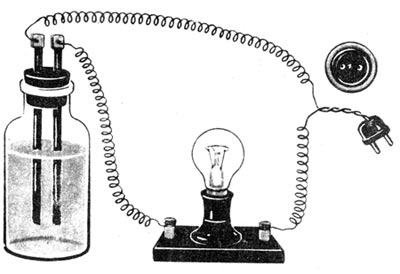
Рис. 21. Прилад для дослідження електропровідності розчинів
Отже, суха сіль електричного струму не проводить. Такий самий результат одержимо, якщо електроди занурити у дистильовану воду. Проте лампочка яскраво спалахне, якщо змішати сіль із дистильованою водою і занурити електроди у водний розчин солі. Електричний струм проводять також водні розчини лугів і кислот. Розчин цукру у воді електричного струму не проводить.
Чому водні розчини одних речовин проводять електричний струм, а інші – не проводять?
Електричний струм – це спрямований рух електронів. Електрична провідність розчинів електролітів зумовлена наявністю в них позитивно і негативно заряджених йонів, які утворюються з молекул або кристалів речовин під впливом води. У речовин з йонним або ковалентним сильнополярним хімічним зв’язком під дією полярної молекули води такі йони утворюються. Але якщо ці речовини розчинити в інших неполярних розчинниках (бензин, гас), йони не утворюються і струму вони проводити не будуть. У ковалентних неполярних сполуках йонів немає, неполярні молекули не притягуватимуть диполі води, тому розчин, наприклад, цукру струму не проводить.
Отже, у водних розчинах кислот, солей і лугів виникають заряджені частинки – йони, завдяки чому їх розчини проводять електричний струм.
Електроліти і неелектроліти
| Речовини | |
| Електроліти Електролітами називають речовини,водні розчини яких проводять електричний струм. До таких речовин належать солі, луги і кислоти. У цих речовинах є іонний або ковалентний сильнополярний хімічний зв’язок. |
Неелектроліти Неелектролітами називають речовини, водні розчини яких не проводять електричного струму. До таких речовин належать, наприклад, кисень, азот, водень, метан, цукор та ін. Для цих речовин характерний ковалентний неполярний зв’язок. |
Серед електролітів є йонні та молекулярні речовини.

М. Фарадей – видатний англійський учений фізик і хімік.
Поділ речовин на електроліти і неелектроліти вперше запропонував англійський учений М. Фарадей, який відкрив закони електролізу, запровадив основну електрохімічну термінологію. Одним із перших розпочав вивчати реакції, які відбуваються у присутності каталізаторів.
Отже, електролітами можуть бути лише речовини з йонним і ковалентним полярним типом хімічного зв’язку. Крім того, молекули розчинника також повинні бути полярними. Лише за таких умов можна очікувати розщеплення молекул або кристалів речовини на йони. Нерозчинні у воді солі, основи є неелектролітами.
Теорія електролітичної дисоціації
Йони – заряджені частинки

С. А. Арреніус
(1859–1927).
Шведський учений, академік. Лауреат Нобелівської премії.
Для пояснення особливостей водних розчинів електролітів шведський вчений С. Арреніус у 1887 році запропонував фізичну суть теорії електролітичної дисоціації.
С.А. Арреніус у 1887 р. сформулював положення про електролітичну дисоціацію.
Він довів, що розклад речовин у розчині на йони відбувається й без дії електролітичного струму. Пізніше його теорія була розвинута багатьма вченими на основі вчення про будову атомів і хімічний зв’язок. Сучасний зміст цієї теорії можна звести до таких положень:
Катіони – позитивно заряджені йони
1. Електроліти під час розчинення у воді розпадаються (дисоціюють) на йони – позитивні і негативні. (Слово «йон» – з грецької означає «мандрівний». У розчині йони безладно переміщуються у різних напрямках).
Аніони – негативно заряджені йони
2. Електролітична дисоціація – оборотний процес, – паралельно з розщепленням молекул на йони відбувається процес сполучення йонів.
3. Під дією електричного струму йони набувають спрямованого руху: позитивні йони переміщуються до катода, тому називаються катіонами, негативно заряджені – до анода, тому називаються аніонами.
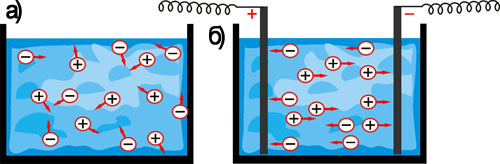
Рис. 22. а) Хаотичний рух йонів у розчинах і розплавах.
б) Спрямований рух йонів при пропусканні постійного електричного струму крізь електроліт.
4. Йони відрізняються від атомів як будовою так і властивостями.
Атом Na ![]() ; йон Na
; йон Na ![]() .
.
Наприклад, атоми Натрію утворюють просту речовину – метал натрій з чітко вираженими металічними властивостями. Атоми Натрію легко віддають електрон зовнішнього рівня, тому атоми хімічно активні, за звичайних умов окиснюються на повітрі, реагують з водою та інше. Йони Натрію не віддають електронів, тому не можуть окиснюватися і з водою не реагують. Атоми Хлору утворюють просту речовину Хлор – отруйний газ з різким неприємним запахом. Атоми Хлору легко приєднують електрон, тому відновлюються. Йони Хлору електронів не приєднують. Кухонна сіль NaCl утворена йонами Na+ і Cl– не отруйна, немає запаху, не містить металічного натрію.
Підсумок:
- Процес розпаду речовин на йони під час їх розчинення називають електролітичною дисоціацією.
- Електроліти проводять електричний струм. Це речовини з йонним або ковалентним полярним зв’зком.
- Неелектроліти не проводять електричний струм. Це речовини з ковалентним неполярним зв’язком.
- Йони – це заряджені частинки, в які перетворюється атом в результаті віддачі або приєднання електронів.
- У розчинах електролітів, що є молекулярними речовинами, відбувається два процеси. Перший – розпад молекул на йони (дисоціація), а другий – сполучення молекул у йони (асоціація).
?
- Поясніть, чому розчин кухонної солі проводить електричний струм, а розчин цукру – ні.
- Які речовини відносяться до електролітів? Дайте визначення.
- Які речовини відносяться до неелектролітів? Дайте визначення.
- Що називається електролітичною дисоціацією?
- Чим обумовлена електрична провідність розчинів електролітів?

















