Ненасичені етиленові вуглеводні (алкени, олефіни)
Існують вуглеводні в яких атоми Карбону сполучені з меншим числом атомів Гідрогену, ніж це потрібно для повного насичення чотирьох валентностей Карбону. У цих випадках валентності сусідніх атомів Карбону, що залишаються вільними, насичують одна одну й між атомами Карбону виникають подвійні або потрійні зв’язки.
CnH2n –ен (–илен,-ілен).
Вуглеводні з подвійними й потрійними зв’язками між атомами Карбону дістали назву ненасичених на відміну від відомих вам насичених вуглеводнів. Ми розглянемо ненасичені етиленові та ацетиленові вуглеводні.
Представником етиленових вуглеводнів є етилен, молекулярна формула якого – С2Н4.
Будова молекули етилену
Якщо навколо двох взаємно зв’язаних атомів Карбону розмістити чотири атоми Гідрогену, то структурну формулу етилену треба було б зобразити так:
![]()
C2H4 етилен
Однак вільних зв’язків не повинно бути, а тому утворюється новий зв’язок між атомами Карбону. Якщо позначити зв’язки між атомами електронними парами, то отримаємо електронну формулу:
![]()
СН2=CН2
Кожна риска структурної формули зображає одну пару електронів. Експериментально доведено, що один із зв’язків атома Карбону слабший від другого. У молекулі етилену гібридизується одна s- і дві р-електронні хмари атомів Карбону (sр2-гібридизація). Тоді кожен атом Карбону має по три (всього шість) гібридні електронні хмари й по одній (всього дві) негібридній р-електронній хмарі. Дві з гібридних електронних хмар атомів Карбону взаємно перекриваються у тій самій площиній, утворюючи між атомами Карбону σ-зв’язок. Решта, чотири гібридні електронні хмари обох атомів Карбону, перекриваються у тій самій площині з чотирма s-електронними хмарами атомів Гідрогену і також утворюють чотири σ-зв’язки. Дві негібридні р-хмари атомів Карбону взаємно перекриваються в площині, перпендикулярній до площини σ-зв’язків, тобто, утворюється один π-зв’язок. Отже, в молекулі етилену між атомами Карбону є один σ- і один π-зв’язки. π-зв’язок значно слабший за σ-зв’язок, він легко розривається під дією реагентів. Для атомів Карбону по місцю подвійного зв’язку неможливе вільне обертання атомів.
![]()
![]()
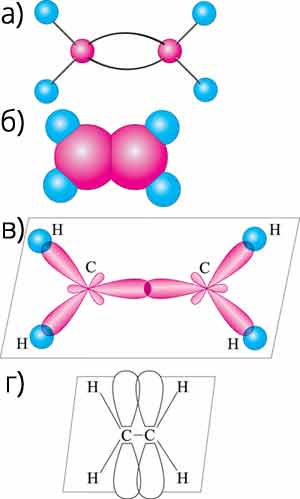
а) кулестержнева модель; б) масштабна модель; в) структурна формула; г) електронна формула
Таблиця 10. Гомологічний ряд етиленових вуглеводнів
|
Агрегатний стан |
Молекулярна формула |
Напівструктурна формула |
Назва |
|
Газ –»– –»– –»– Рідина –»– –»– –»– –»– Тверда речовина |
С2Н4 С3Н6 С4Н8 С5Н10 С6Н12 С7Н14 С8Н16 С9Н18 С10Н20 С19Н38 |
СН2=СН2 СН3–СН=СН2 СН3–СН2–СН=СН2 СН3–(СН2)2–СН=СН2 СН3–(СН2)3–СН=СН2 |
Етилен, етен Пропілен, пропен 1–Бутен, 1–бутилен 1–Пентен, 1–пентилен 1–Гексен, 1–гексилен
|
Фізичні властивості
Етилен – безбарвний газ, майже без запаху, трохи легший за повітря. Mr(С2Н4) = 28, погано розчиняється у воді. У вільному вигляді не зустрічається через високу активність. Етилен утворюється під час переробки нафти.
Хімічні властивості
Хімічні властивості етилену переважно визначаються наявністю в його молекулі подвійного зв’язку. Для них характерні реакції приєднання.
1. Як й інші вуглеводні, етилен горить світним полум’ям з утворенням вуглекислого газу й води:
С2Н4 + 3О2 → 2СО2 + 2Н2О.
2. За наявності каталізатора (платини або нікелю) при нагріванні може приєднатися (за місцем кратного зв’язку) водень:
СН2 = CН2 (етен) + Н2 ![]() СН3− CН3 (етан) , або С2Н4 + Н2
СН3− CН3 (етан) , або С2Н4 + Н2 ![]() С2Н6
С2Н6
Реакцію приєднання водню називають реакцією гідрування.
3. Етилен приєднує воду за наявності каталізатора сульфатної кислоти з утворенням спирту:
C2H4 (етен) + H2O ![]() C2H5OH (етанол).
C2H5OH (етанол).
Реакцію приєднання води називають реакцією гідратації. Таку реакцію застосовують для промислового добування етанолу.
4. Під час пропускання етилену через бромну воду відбувається її знебарвлення:
СН2 = CН2 + Br2 ![]() СН2Br − CН2Br (диброметан), або С2Н4 + Br2 → C2H4Br2
СН2Br − CН2Br (диброметан), або С2Н4 + Br2 → C2H4Br2
Реакція приєднання галогенів називається реакцією галогенування.
Якщо пропустити етилен крізь розчин калій перманганату, останній знебарвиться.
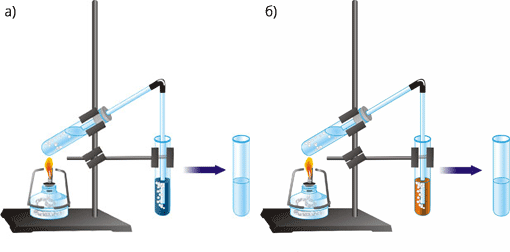
Рис. 51. Якісна реакція на етилен.
а) добування етилену в лабораторії й знебарвлення КМnO4;
б) добування етилену в лабораторії й знебарвлення бромної води.
5. Етилен приєднує галогеноводні перетворюючись на галогенопохідне насиченого вуглеводню:
С2Н4 (етилен) + НCl → C2H5Cl (хлоретан)
6. Молекули етиленових вуглеводнів можуть сполучатися між собою з утворенням ланцюгових молекул при підвищеній температурі й тиску за наявності каталізатора:
СН2 = СН2 + СН2 = СН2 + СН2 = СН2… →
– СН2 – СН2 – СН2 – СН2 – СН2 – СН2 –… →
(– СН2 – СН2 –)n
Процес сполучення багатьох однакових молекул у більші називається реакцією полімеризації.
Схема 7. Хімічні властивості
 Етилен застосовують для прискорення дозрівання плодів, виготовлення вибухових речовин, поліетилену, для наркозу (суміш 80% С2Н4 і 20% О2), добування пального з високим октановим числом.
Етилен застосовують для прискорення дозрівання плодів, виготовлення вибухових речовин, поліетилену, для наркозу (суміш 80% С2Н4 і 20% О2), добування пального з високим октановим числом.
Підсумок
- Будова молекули етилену – площинна. Валентний кут – 120°.
Довжина С–С зв’язку 0,134 нм, міцність С–С зв’язку 620 кДж/моль.
Зв’язки – три σ й один π в атома С за місцем кратного зв’язку (неможливий вільний рух атомів по π-зв’язку). - Ненасиченими називають органічні сполуки, що містять між атомами Карбону подвійні зв’язки.
- Ненасичені вуглеводні характеризуються реакціями приєднання різних речовин. Так, вони легко приєднують галогени, галогеноводневі кислоти, водень.
- На відміну від насичених, ненасичені вуглеводні легко окиснюються при низьких температурах, при цьому дія окисників спрямована на кратний зв’язок. Окиснення повільно відбувається навіть під дією кисню повітря.
- Ненасичені вуглеводні здатні до реакцій полімеризації.
- Назву олефіни вони дістали тому, що газоподібний етилен при сполученні з хлором утворює маслоподібний продукт приєднання – дихлоретан (лат. oleum – «масло»).
?
- Які вуглеводні називаються ненасиченими?
- У чому суть sp2-гібридизації? Яка відмінність її від sp3-гібридизації?
- У чому відмінність σ і π-зв’язків у молекулах етилену?
- Поясніть, чому атоми Карбону не можуть вільно обертатися при кратних зв’язках?
- Який тип реакцій характерний для етилену?
- Які види ізомерії притаманні етиленовим вуглеводням?
- Назвіть галузі застосування етилену.
Для тих, хто хоче знати більше
 Володимир Васильович Марковников (1838 – 1904 р. р.), професор Московського університету. Синтезував ряд сполук, розвинув ідею О. Бутлерова про взаємний вплив атомів у молекулах. Досліджував нафтові родовища. Відкрив у складі кавказьких нафт нафтени й ґрунтовно вивчив ці сполуки.
Володимир Васильович Марковников (1838 – 1904 р. р.), професор Московського університету. Синтезував ряд сполук, розвинув ідею О. Бутлерова про взаємний вплив атомів у молекулах. Досліджував нафтові родовища. Відкрив у складі кавказьких нафт нафтени й ґрунтовно вивчив ці сполуки.
♦ Пропілен і наступні вуглеводні ряду етилену реагують з галогеноводнями відповідно до правила В. В. Марковникова.
♦ Окиснення етену:
3С2Н4 (етилен) + 2KMnO4 + 4H2O → 3CH2OH–CH2OH (етиленгліколь) + 2MnO2 + 2KOH.
Схема 8. Способи добування етиленових вуглеводнів
|
1. CnH2n+2 |
Дегідрування насичених вуглеводнів: |
| 2. CnH2nГ2 + Ме(а) → СnН2n + МеГ |
Взаємодія активних металів з дигалогенпохідними алканів: |
|
3. CnH2n+1Г + КОН (спиртовий розчин лугу) → СnН2n + КГ + Н2О |
Взаємодія моногалогенпохідних алканіві з спиртовим розчином лугу: |
|
4. С2Н5ОН |
Дегідратація спиртів: |
|
5. СН ≡ СН + Н2 |
Гідрування ацетилену: |
|
6. 2СН4 |
Дегідрування метану: |


















