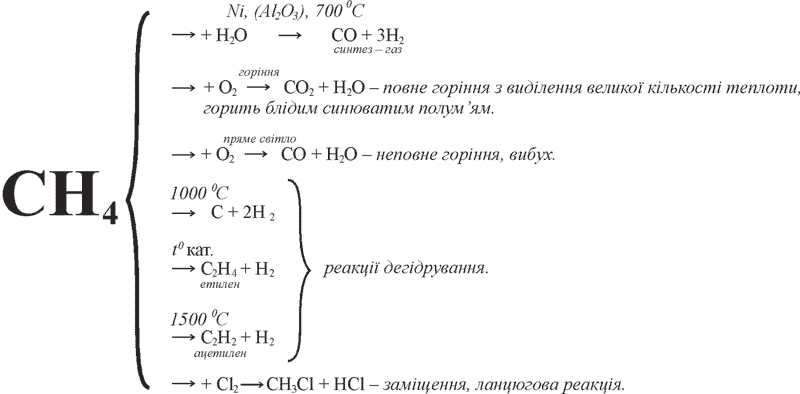
Склад й будова молекули метану
Найпростішою органічною сполукою, до складу якої входить лише один атом Карбону й чотири атоми Гідрогену є метан. Його молекулярна формула – СН4.
Пригадаємо електронну будову атомів Гідрогену й Карбону. В атома Гідрогену у зовнішньому енергетичному рівні знаходиться один неспарений електрон, електронна конфігурація якого – 1s1. У атома Карбону шість електронів рухаються на двох енергетичних рівнях. На зовнішньому енергетичному рівні атома Карбону у збудженому стані міститься чотири неспарені електрони, завдяки яким він утворює чотири зв’язки з одновалентними атомами Гідрогену. Електронна й структурна формули метану матимуть такий вигляд:
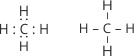
В утворенні зв’язків між атомом Карбону та атомами Гідрогену приймають участь одна s– і три p–орбіталі атома Карбону й чотири s–орбіталі від чотирьох атомів Гідрогену. Під час утворення молекули метану одна s– і три p–орбіталі атома Карбону змінюють свою форму й утворюється чотири однакові гібридизовані орбіталі.
Пригадай: Що таке гібридизація? Що таке σ–зв’язок?
Оскільки в цьому випадку в гібридизації приймають участь одна s– і три p–орбіталі атома Карбону, то такий вид гібридизації називається sp3– гібридизацією (читається ес–пе–три).
Валентний кут між осями гібридизованих орбіталей становить 109°28′. Внаслідок перекривання чотирьох гібридизованих sp3–орбіталей атома Карбону й чотирьох s–орбіталей від чотирьох атомів Гідрогену, утворюється міцна молекула метану з чотирима ковалентними зв’язками. Молекула метану має тетраедричну будову.
У молекулі метану чотири σ–зв’язки С–Н, кожний з яких утворюється перекриванням s–, sp3–електронних орбіталей. Довжина зв’язку становить 0,109 нм, а енергія дорівнює 432 кДж/моль.
Тетраедричну молекулу метану наочно можна виразити такими просторовими моделями:
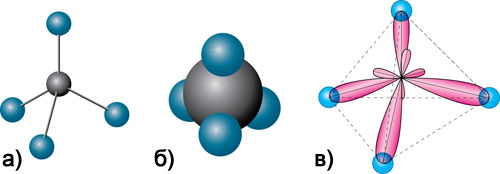
Рис. 45. Кулестержнева (а), масштабна (б) модель молекули метану, утворення σ–зв’язків у молекулі метану (в).
Фізичні властивості метану і знаходження в природі
Метан (СН4) – це газ без кольору й запаху, мало розчинний у воді, але добре розчинний в органічних розчинниках; майже в два рази легший за повітря. У природі метан утворюється внаслідок гниття рослинних решток без доступу повітря, розкладу кам’яного вугілля під землею. Звідси походить його назва «болотний» або «рудниковий» газ. Виділення цього газу можна спостерігати на поверхні заболочених водойм. У значній кількості він міститься в попутних газах нафтодобування та газах крекінгу нафтопродуктів, а також у газах, які виділяються при сухій перегонці дерева, торфу, кам’яного вугілля. Як основа природного газу (90-98%) метан утворюється в надрах Землі, ймовірно внаслідок взаємодії розжарених карбідів металів з водяною парою. Метан входить до складу атмосфери планет Юпітера та Сатурна.
Хімічні властивості метану
Метан хімічно малоактивний.
1. Горіння метану. У суміші з повітрям або киснем метан утворює вибухову суміш, тому він небезпечний у побуті (витікання через крани) й у видобувних шахтах. Для виявлення цього газу до нього додають речовини, що мають запах.
Метан горить синюватим полум’ям. Внаслідок згоряння метану утворюється вуглекислий газ й вода. У разі нестачі кисню відбувається неповне окиснення метану з утворенням вуглецю (у вигляді сажі) та карбон (II) оксиду (чадний чаз). Слід знати, що в умовах неповного окиснення метану його полум’я набуває жовтого забарвлення завдяки розжареним частинкам вуглецю, який утворюється під час розкладання метану.

Несправна й справна газова конфорки.
За продуктами реакції можна дослідити якісний склад метану.
Проведемо дослід. Пробірку, заповнену метаном (витісненням повітря), перевернемо догори дном, відкриємо, підпалимо газ. Метан горить. На стінках пробірки утворюються крапельки води, що свідчить про наявність у речовині Гідрогену. Пробірку перевернемо догори отвором, вллємо 0,5-1мл ваняної води, енергійно збовтаємо. Вапняна вода стає каламутною. Це підтверджує наявність у речовині Карбону:
СН4 + 2О2 → СО2 + 2Н2О
Са(ОН)2 + СО2 → СаСО3 + Н2О.
2. Терміний розклад метану. З нагріванням метану до високої температури без доступу кисню відбувається розклад метану: за температури +1000°С з утворенням вуглецю й водню, а в печах спеціальної конструкції метан розкладається на ацетилен й водень.
Поміркуй! Навіщо необхідне світло в реакціях заміщення?
3. Реакції заміщення. Для метану характерні реакції заміщення. На світлі за звичайної температури хлор поступово (по ступеням) витісняє з молекули метану Гідроген, утворюючи галогенпохідні метану. Утворення галогенпохідних відбувається за ланцюговим вільнорадикальним механізмом з утворенням суміші сполук: CH3CI, CH2CI2, CHCI3, CCI4. При вбиранні світлової енергії молеки хлору розпадаються на атоми:
![]()
Атоми Хлору з одним неспареним електроном хімічно дуже активні. При їх зіткненні з молекулою метану відбувається реакція, в результаті якої утворюється вільний хімічно дуже активний радикал –метил (–СН3). Активність радикалу метилу пояснюється наявністю неспареного електрона (невикористаної валентності).
Реакції, в результаті яких відбівається ланцюг послідовних перетворень, називаються ланцюговими реакціями. Наприклад, реакції заміщення метану можна зобразити за допомогою таної схеми:
CH4 (метан) + CI2 ![]() CH3CI (хлорметан) + HCI
CH3CI (хлорметан) + HCI
CH3CI (хлорметан) + CI2 ![]() CH2CI2 (дихлорметан) + HCI
CH2CI2 (дихлорметан) + HCI
CH2CI2 (дихлорметан) + CI2 ![]() CHCI3 (трихлорметан) + HCI
CHCI3 (трихлорметан) + HCI
CHCI3 (трихлорметан) + CI2 ![]() CCI4 (тетрахлорметан) + HCI
CCI4 (тетрахлорметан) + HCI
Під дією прямих сонячних променів реакція з хлором протікає бурно – з вибухом, за реакцією: CH4 + 2CI2 → C + 4HCI.
Хімічні властивості метану можна зобразити за допомогою нижчеподаної схеми.
Схема 5. Хімічні властивості метану
За звичайних умов метан не окиснюється таким окисником, як калію перманганат KMnO4 (фіолетове забарвлення не зникає). Не діють на метан кислоти та луги. Метан доволі інертна сполука.
Застосування
Завдяки теплоті, що виділяється внаслідок згоряння метану, він використовується як паливо в побуті та багатьх промислових процесах.
Сировина для виробництва метанолу, каучуку, розчинників, етилену, синтез – газу, сажі, ацетилену, ґуми.
Широко використовують продукти хімічних перетворень метану: сажа для виготовлення ґуми, друкарських фарб; водень – для синтезу амоніаку; ацетилен – для виробництва пластмас, метилового спирту; розчиненням хлоргідрогену у воді добувають хлоридну кислоту.
Газ хлорметан (СН3Сl) легко переходить у рідкий стан й вбирає багато теплоти при випаровуванні, тому його застосовують як холодоагент в холодильних установках. Газ С2Н5СІ – використовують для наркозу; СНІ3 – як антисептик в хірургії, виготовлення мазі в стоматології; СН3СІ – виробництво фосгену (СОСІ2).
Дихлорметан СН2Сl2, трихлорметан СНСІ3, тетрахлорметан ССІ4 – рідини. Вони застосовуються як розчинники. Тетрахлорметан ССІ4 застосовують також як протипожежний засіб (особливо тоді, коли для цього не можна використати воду, тому що важка негорюча пара цієї речовини, що утворюється при випаровуванні, швидко ізолює предмет, охоплений полум’ям, від кисню повітря).
Підсумок:
-
Будова молекули метану – тетраедрична.
Валентний кут – 109°28′.
Довжина С–С зв’язку у парафінів дорівнює 0,154 нм.
Зв’язки – 4σ у кожного атома Карбону (можливий вільний рух атомів навколо σ–зв’язку).
Гібридизація – sp3.
- Типовою реакцією метану є реакція заміщення.
- Метан не здатний до реакцій приєднання, оскільки в його молекулі всі валентності насичені.
- Під час термічного розкладу, в залежності від умов, можуть утворюватися різні продукти.
?
- Яку найпростішу органічну сполуку ви знаєте?
- Чому метан називають «болотним» газом?
- Завдяки якій властивості метану його можна спостерігати у вигляді бульбашок на поверхні заболочених водойм?
- Яка будова молекули метану?
- Які хімічні властивості метану?
- Де застосовують метан та його галогенопохідні?
- Яких мір безпеки слід дотримуватись при користуванні органічними розчинниками?
- Чи можна виявити метан у повітрі видобувної шахти за запахом чи смаком?
Для допитливих
Перший на Україні газовий завод для освітлення вулиць газом з’явився у 1858 році у Львові. Пізніше були побудовані подібні у 1871 році в Харкові й в 1872 році – у Києві. Світильний газ добували в основному прожарюванням вугілля або дерева. На газовому заводі в Києві світильний газ добували із бакинської нафти й деревини. Запалювали газові ліхтарі на вулицях спеціально призначені люди – ліхтарники. Вони носили на плечах драбину, за допомогою якої піднімались на верх стовпа й запалювали сірником газовий світильник.

Газовий ліхтар 1879 р.
Дія галогенопохідних на організм
Особливо небезпечними для організму являються хлорорганічні розчинники тетрахлорметан та дихлорметан. Вони легко всмоктуються (навіть через шкіру), викликаючи наркотичнуй отруйну дію на центральну нервову систему й особливо пошкоджують печінку та нирки, викликають коматозний стан. Допустимі конценртації парів становлять: ССІ4 – 0,002 мг/л, С2Н4Сl2 – 0,001 мг/л. При отруєнні парами цих речовин потерпілого виносять на свіже повітря, дають кисень. При попаданні рідин в організм необхідно викликати блювання, промити шлунок й відправити у найближчий лікувальний заклад.