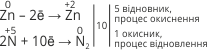Основні положення теорії окисно-відновних реакцій
Всі реакції можна поділити на два типи:
1. Реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин, наприклад:
![]()
2. Реакції, які відбуваються із зміною ступеня окиснення атомів.
Розглянемо реакцію між двома простими речовинами – натрієм і хлором: ![]()
Натрій і Хлор – прості речовини, ступінь окиснення яких рівний нулю. У результаті сполучення атомів цих речовин утворюється йонна сполука NaCl. Два електрони від двох атомів Натрію перейшли до двох атомів Хлору.
![]() , або Na0 – 1ē → Na+1, Cl0 + 1ē → Cl–1.
, або Na0 – 1ē → Na+1, Cl0 + 1ē → Cl–1.
Зміна ступеня окиснення пов’язана зі зміною або переходом електронів від одного елемента до іншого.
Розглянемо основні положення теорії окисно-відновних реакцій.
1. Окисненням називають процес віддачі електронів атомом, молекулою або йоном. Атоми, молекули або йони, що віддають електрони, називають відновниками.
Елемент відновник втрачає електрони.
Наприклад: відновник Zn0 – 2ē → Zn+2, процес окиснення.
S+4 – 2ē → S+6
S–2 – 8ē → S+6
S–2 – 2ē → S0
Втрата атомом електронів (ē) веде до збільшення позитивного і зменшення негативного заряду.
2. Відновленням називають приєднання електронів атомом, молекулою або йоном. Атоми, молекули або йони, що приєднують електрони, називають окисниками.
Наприклад: окисник S0 + 2ē → S–2, процес відновлення.
Елемент окисник отримує електрони.
Cu+2 + 2ē → Cu0
S+6 + 8ē → S–2
N+5 + 3ē → N+2
Приєднання атомом електронів веде до збільшення негативного і зменшення позитивного заряду.
3. Число електронів, що їх віддає відновник, дорівнює числу електронів, які приєднує окисник.
4. Окиснення завжди супроводжується відновленням, і, навпаки, відновлення завжди пов’язане з окисненням.
Таблиця 3. Складання рівнянь окисно-відновних реакцій
Як приклад, розглянемо реакцію між цинком і розбавленою нітратною кислотою.
| Алгоритм | Схема реакції |
| 1. Записуємо схему реакції. | Zn + HNO3 → Zn(NO3)2 + H2O + N2 |
| 2. Визначаємо ступені окиснення елементів у лівій і правій частинах рівняння і підкреслюємо ті елементи, які змінили ступінь окиснення. | |
| 3. Виписуємо знаки хімічних елементів, атоми чи йони яких змінюють ступінь окиснення. |
Zn0 → Zn+2 |
|
4. Знаходимо скільки електронів віддають або приєднують відповідні атоми чи йони. Складаємо схему електронного балансу, знаходимо найменше спільне кратне чисел відданих і приєднаних електронів (їх кількість має бути однаковою). Вказуємо окисник і відновник. У схемі N+5 → N20, перед N+5 ставимо коефіцієнт два тому, що для утворення молекули N2 повинно прийняти участь два атоми (йони): |
|
| 5. Знайдені коефіцієнти ставим перед відповідними формулами спочатку в правій, а потім в лівій частині рівняння. | 5Zn0 + HNO3 → 5Zn(NO3)2 + H2O + N2 |
| 6. Знаходимо коефіцієнти для формул усіх інших речовин. Підраховуючи число атомів Нітрогену треба пам’ятати, що в правій частині рівняння Нітроген міститься у двох речовинах: Zn(NO3)2 і N2, тому підраховуємо спочатку число атомів Нітрогену справа і зрівноважуємо в лівій частині рівняння. Зрівноважуємо число атомів Гідрогену. Якщо коефіцієнти підібрані правильно, то число Оксигену буде однакове в обох частинах рівняння. | 5Zn + 12HNO3 = 5Zn(NO3)2 + 6H2O + N2. |
Підсумок:
- Окисно-відновні реакції – це реакції, під час яких змінюються ступені окиснення елементів.
- Окисно-відновні реакції – це єдність двох протилежних процесів: окиснення і відновлення.
- Атоми, молекули або йони, що віддають електрони, називаються відновниками, а самі вони окиснюються.
- Атоми, молекули або йони, що приєднують електрони, називаються окисниками, а самі вони відновлюються.
- Окиснення – це процес віддавання електронів атомом або йоном.
- Відновлення – це процес приєднання електронів атомом або йоном.
- Під час окисно-відновних реакцій один елемент окиснюється, а інший – відновлюється.
?
- Які реакції називаються окисно-відновними?
- Які типи реакцій можуть відноситись до окисно-відновних реакцій? Наведіть приклади.
- Що таке окисник і відновник? Які елементи періодичної системи тільки відновники?
- В яких випадках неметалічні елементи можуть виступати як окисники і як відновники? Наведіть приклад.
- Чому окисно-відновні реакції – це єдність двох протилежних процесів?
Експериментуємо
Дослідження чистоти води
В одну пробірку налийте чистої води, а в іншу – води із болота. Добавте в обидві пробірки невелику кількість розчину окисника – калій перманганату. У чистій воді розчин буде рожевим, а у воді з болота – знебарвиться. В теплу погоду в болтній воді накопичуються органічні сполуки, які відновлюють калій перманганат, змінюючи його забарвлення.