Речовини атомної будови, як правило, практично не розчиняються в жодному розчиннику.
Є речовини, які змішуються між собою в будь-яких співвідношеннях, наприклад вода та етиловий спирт. Рідини – вода, бензен, спирт, розплавлені метали та інші мають здатність поглинати, розчиняти в собі інші рідини, гази, тверді речовини, утворюючи однорідні системи – розчини. В деяких випадках розчини утворюються при довільному співвідношенні речовин (спирт і вода), але, як правило, розчинність більшості речовин обмежена.
Розрізняють насичені, ненасичені, пересичені, концентровані і розбавлені розчини.
Тверді речовини, більшість газів і рідких речовин розчиняються у воді в певних співвідношеннях. Так, при 20ºС у воді масою 100 г може розчинитися купрум (II) сульфат, маса якого не перевищує 20,7 г. При цій же умові розчиняється натрій хлорид масою 36 г. Більше натрій хлориду розчинитися в цьому розчині не може, тобто розчин є насиченим.
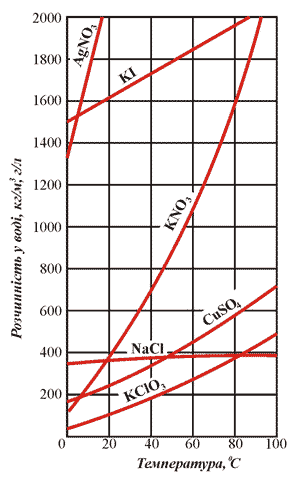
Рис.12. Криві розчинності деяких солей.
Розчин, у якому речовина більше не розчиняється за даної температури, називається насиченим.
Розчин, у якому речовина ще може розчинятися за даної температури, називається ненасиченим.
Наприклад, якщо у воді масою 100 г розчинити натрій хлорид масою 20 г при температурі 20ºС, утворюється ненасичений розчин.
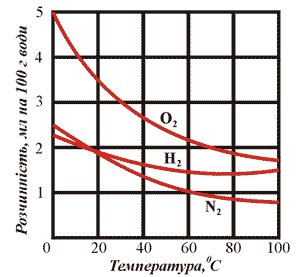
Рис. 13. Криві розчинності деяких газів.
Пересичений розчин – це розчин, в якому при даній температурі розчинено більше розчинної речовини, яка може розчинятися за нормальних умов.
Як утворюється пересичений розчин? При зниженні температури насичений розчин може за певних умов зберігати зазначену концентрацію речовини, тобто концентрація розчину може виявитися вищою, ніж у насиченому розчині при даній температурі (наприклад, фруктове варення).
Насичені розчини є стабільними системами, при даній температурі вони можуть існувати як завгодно довго без зміни концентрації. Пересичені розчини є нестабільними системами, тобто досить перемішати або кинути у такий розчин крихітний кристалик речовини, як відразу ж починає виділятися тверда фаза. Цей процес відбувається доти, поки концентрація речовини не досягне концентрації насиченого розчину при даній температурі (цим пояснюється кристалізація варення при довготривалому зберіганні).
Розбавлений розчин – це розчин, в якому мало розчиненої речовини.
Концентрований розчин – це розчин, в якому багато розчиненої речовини. Поняття «концентрований розчин» та «насичений розчин», як «розбавлений розчин» і «ненасичений розчин», не є тотожними, бо ґрунтуються на різних ознаках. Перші в обох парах понять пов’язані з кількісним складом розчину, другі – з розчинністю речовини.

Рис. 14. Розчинність газів у воді, нагрітій більше
за 50ºС зменшиться через утворення бульбашок.
Досить часто розчинність твердих та рідких речовин визначають масою речовини, яка може розчинитися в 100 г розчинника за певної температури, щоб розчин став насиченим. Розчинність газів визначають об’ємом газу, який може розчинитись в 1 л розчинника за певної температури. Ця величина називається коефіцієнтом розчинності.
Наприклад: у 100 г води при температурі 10ºC може розчинитися 51,7 г Pb(NO3)2.
Процес розчинення речовини залежить від різних чинників. В залежності від природи розчиненої речовини їх можна поділити на три групи:
а) добре розчинні, якщо у 100 г води розчиняються більше 10 г речовини. Це речовини з ковалентним полярним і йонним зв’язком. Наприклад, цукор, сіль, спирт, луги;
б) малорозчинні, якщо розчиняються менше 1 г речовини. Це речовини з ковалентним неполярним зв’язком. Наприклад, кисіль, азот, гіпс;
в) практично нерозчинні, якщо в розчин переходить менше 0,01 г речовини. Наприклад, олія, гас.
Речовини йонної природи (солі, луги), або речовини, молекули яких є полярними (кислоти), добре розчиняються у полярних розчинниках, наприклад у воді. Речовини з неполярними молекулами – азот N2, метан – СН4, олія та багато інших, а також ті, що мають атомну будову, є нерозчинними у воді, або розчиняються дуже мало.
Розчинність більшості твердих речовин з підвищенням температури збільшується. Розчинність газів, навпаки, зменшується з підвищенням температури. Тиск впливає лише на розчинність газів. Із зменшенням тиску, розчинність газу зменшується.
| Вплив різних чинників на процес розчинення |
→ | природа розчиненої речовини | → | добре розчинні (в 100 г води 10 г р.р.) (іонні, к. п.) |
| → | малорозчинні (в 100 г – 0,01-1 г р.р.) (к. н.) | |||
| → | погано розчинні | |||
| → | практично не розчинні (в 100 г менше 0,01 г р.р.) | |||
| → | природа розчинника | |||
| → | температура – з підвищенням температури збільшується розчинність рідин і твердих речовин, а газів – зменшується |
|||
| → | тиск – з підвищенням тиску збільшується розчинність газів | |||
| → | концентрація – чим менша, тим розчинність краща | |||
| → | перемішування подрібнених речовин | |||

Рис.15. Якщо відкрити пляшку з газованою водою, тиск у ній зменшиться і почне виділятися газ.
Для того, щоб прискорити процес розчинення твердих речовин, використовують кілька прийомів:
- речовину перед розчиненням подрібнюють, щоб збільшити поверхню контакту з розчинником;
- розчинення здійснюють при нагріванні;
- суміш речовини і розчинника перемішують.
Підсумок:
- За кількістю розчиненої речовини розчини поділяють на: насичені, ненасичені, перенасичені, розбавлені і концентровані.
- Розчинність речовини показує, яка маса її може розчинитися у 100 г розчинника при даній температурі, щоб розчин став насиченим.
- Вода – універсальний розчинник, тому що молекула води полярна і легко руйнує кристалічні ґратки розчинних речовин, особливо речовин з йонним чи ковалентним полярним зв’язком.
?
- Дайте визначення поняттю «розчин».
- Що розуміють під терміном «розчинність»? Наведіть приклади добре розчинних, малорозчинних та практично нерозчинних речовин?
- Які умови впливають на процес розчинення речовин?
- Чи може бути розчин одночасно розбавленим і насиченим; концентрованим і ненасиченим?
- Яку класифікацію розчинів ви запам’ятали?
Для допитливих
Абсолютно нерозчинних речовин у природі немає. Якщо у воду опустити срібну ложку, то метал у дуже малій кількості переходить у розчин. Така «срібна» вода набуває антимікробних властивостей й на відміну від звичайної води може зберігатися тривалий час.
Експериментуємо
«Цікаві кристали»
При охолоджуванні концентрованого розчину солі, при випаровуванні води з нього, сіль може виділятися з розчину, кристалізуватись. Особливо цікаво відбувається кристалізація з перенасичених розчинів деяких солей.
Приготуйте перенасичений розчин тіосульфату натрію Na2S2O3 • 5Н2О. Для цього колбу з 250 г тіосульфату натрію нагрівайте на киплячій водяній бані. Через деякий час усі кристали зникнуть. Це означає, що сіль розчиняється в кристалізаційній воді. Якщо невелика кількість кристалів не зникає, добавте в колбу кілька мілілітрів води.
Закрийте колбу ватним тампоном і поставте не струшуючи охолоджуватись. В охолоджену рідину вставте скляну трубочку, звужену в нижній частині, і опустіть кристалик тіосульфату натрію. Відбувається досить ефективне явище – уся маса пересиченого розчину перетворюється в суцільну кристалічну масу.


















1 коментар
Ольга
підскажіть будь ласка як вирішити таку задачу
Обчисліть і вкажіть масу сульфатної кислоти що міститься у розчині масою 400г з масовою часткою кислоти 0,6