Поняття про швидкість хімічних реакцій
Хімічна реакція – це хімічний процес, який характеризується швидкістю взаємодії однієї речовини або елемента з іншою.
Деякі хімічні реакції відбуваються миттєво (вибух киснево-водневої суміші, реакції обміну з утворенням осаду), другі – швидко (горіння речовин, взаємодія магнію з кислотою), треті – повільно (іржавіння заліза, гниття органічних решток). Відомі настільки повільні реакції, що людина їх просто не помічає, зокрема перетворення граніту на пісок та глину (відбувається протягом тисяч років).
Швидкість хімічної реакції (υ) оцінюють, виходячи зі зміни кількості частинок (концентрації – С) речовини реагенту чи продукту реакції за одиницю часу.
Концентрація – кількість частинок (атомів, молекул, йонів) реагенту чи продукту реакції.
Коли в рівнянні швидкості хімічної реакції враховуються зміни кількості частинок реагуючих речовин, у його правій частині ставлять знак «мінус», тому що кількість частинок цих речовин зменшується. Якщо початкову кількість частинок речовини позначити С1, а через деякий час t – С2, то швидкість реакції в загальному вигляді можна зобразити так:
![]() де υ – швидкість реакції, С – концентрація (моль/л), ΔС– заміна концентрації певного компонента реакції, t – час (с), τ (тау) – певний проміжок часу.
де υ – швидкість реакції, С – концентрація (моль/л), ΔС– заміна концентрації певного компонента реакції, t – час (с), τ (тау) – певний проміжок часу.
Коли в рівнянні враховується зміна кількості частинок речовин, які утворюються у правій його частині, ставлять знак «плюс», оскільки кількості утворених частинок речовин збільшується:
![]()
Отже, ![]() моль/л/с.
моль/л/с.
Припустимо, що початкова концентрація сульфур (IV) оксиду в реакції окиснення його до сульфур (VI) оксиду була 3 моль/л, а через 50с стала 0,5 моль/л. У цьому випадку швидкість даної реакції дорівнює: ![]() .
.
Це означає, що за кожну секунду в 1 л газової суміші 0,05 моль SO2 перетворюється в SO3.
Які ж чинники впливають на швидкість хімічних реакцій? Навіщо потрібно знати ці чинники?
Хімічні реакції можна поділити на дві групи залежно від їх значення для людини: бажані і небажані. Чим швидше відбувається бажана реакція, тим більше за одиницю часу утвориться потрібного продукту, й тим економічно вигіднішою буде ця продукція. Деякі хімічні реакції завдають шкоди (псування харчових продуктів, процес корозії металів), тому швидкість таких небажаних реакцій потрібно сповільнювати.

Рис. 40. Охолодження продуктів харчування для кращого зберігання або транспортування.
Використовуючи ці знання, технологи проектують заводську апаратуру, в якій відбуватимуться хімічні перетворення, планують її продуктивність.
Дослідимо вплив деяких чинників на швидкість хімічних реакцій.
Лабораторна робота 5. Вплив різних чинників на швидкість хімічних реакцій
Дослід 1. Вплив площі поверхні контакту реагентів
У дві пробірки наливаємо однакові об’єми хлоридної кислоти однакової концентрації. В одну пробірку насипаємо цинкового порошку, а в іншу – стільки ж цинку в гранулах (1–2 гранули). Що спостерігаєте? У якій пробірці швидкість реакції більша?
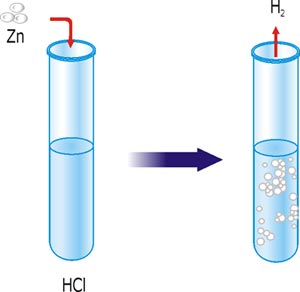
Рис. 41. Взаємодія цинку із хлоридною кислотою.
Ви побачили, що реакція за участю порошку цинку відбулася з більшою швидкістю.
Дослід 2. Вплив концентрації реагентів на швидкість реакції
У дві пробірки помістимо по дві гранули цинку. В одну пробірку наллємо трохи концентрованої хлоридної кислоти, а в іншу – такий же об’єм розбавленої хлоридної кислоти. Що спостерігаємо? У якій пробірці реакція відбувається швидше?
Ми побачили, що реакція проходить швидше з концентрованою кислотою.
Дослід 3. Вплив температури на швидкість хімічної реакції
У дві пробірки покладемо по 1–2 гранули цинку. В обидві пробірки наллємо по 2 мл розбавленої хлоридної кислоти. Одну пробірку злегка нагріваємо. Що спостерігаємо?
Швидкість хімічної реакції під час збільшення температури зростає.
Вплив різних чинників на швидкість хімічних реакцій
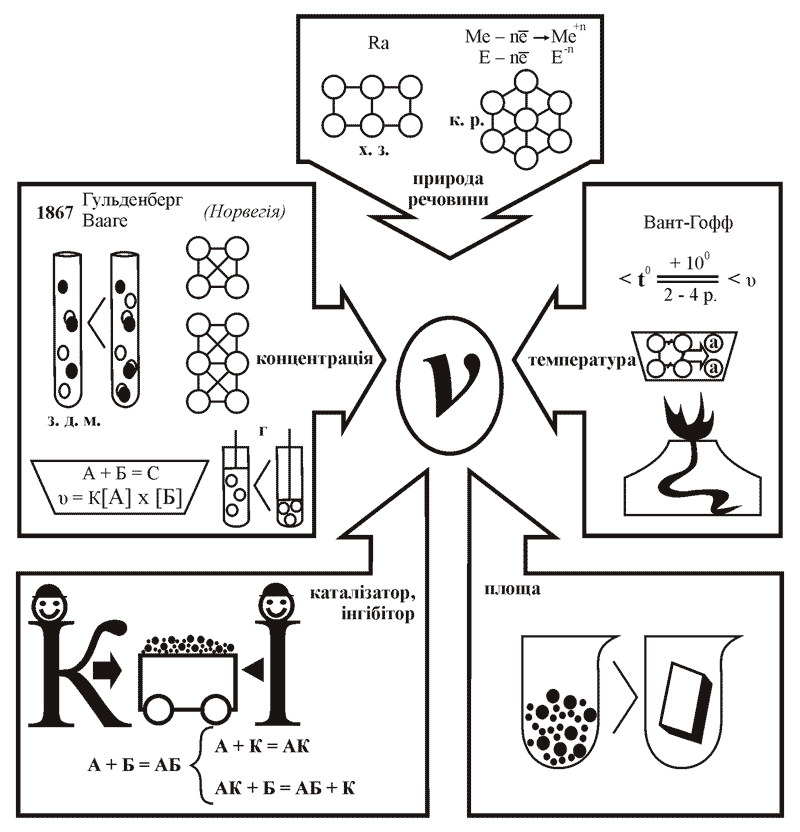
Швидкість хімічних реакцій залежить від багатьох чинників, серед яких п’ять основних: природа реагуючих речовин, їхня температура, концентрація, ступінь подрібненості й наявність каталізатора.
1. Природа реагуючих речовин. Швидкість хімічних реакцій залежить від хімічного складу речовин, густини, радіуса атома, типу хімічного зв’язку, кристалічної ґратки.
Так, хлоридна кислота миттєво взаємодіє з аргентум нітратом, бурхливо реагує з магнієм, активно – із цинком і не взаємодіє з міддю.
2. Ступінь подрібнення речовин, які реагують. Якщо речовина подрібнена, то збільшується поверхня стикання речовин і швидкість реакції між ними зростає. Швидкість реакції прямо пропорційна площі речовин, що реагують.
3. Концентрація речовин, що реагують. Чим більше частинок реагуючих речовин міститься в одиниці об’єму, тим частіше відбуваються зіткнення між ними і вищою є швидкість реакції (хоч і не кожне зіткнення спричиняє взаємодію). Норвезькі вчені К. Гульдберг та П. Вааге сформулювали закон діючих мас для реакції, яка відбувається внаслідок попарних зіткнень між молекулами.
Для газоподібних речовин на швидкість реакцій впливає тиск. З підвищенням тиску швидкість реакції збільшується.
4. Температура речовин, що реагують. За правилом Вант-Гоффа підвищення температури на кожні 10ºC спричиняє зростання швидкості більшості реакцій у 2-4 рази. Це пояснюється тим, що нагрівання речовин сприяє збільшенню числа активних молекул, які вступають у хімічну взаємодію, оскільки мають достатню енергію для здійснення реакції.
5. Наявність каталізатора. Нагадаємо, що каталізатори – це речовини, які прискорюють хімічні реакції, а самі не входять до продуктів реакції. Виявляється, що каталізатор бере участь у реакції, утворюючи з вихідними речовинами проміжні продукти, які швидко руйнуються, і каталізатор вивільняється з них.
Реакції, що відбуваються за наявності каталізаторів, називаються каталітичними, а сам процес зміни швидкості реакції під впливом каталізатора – каталізом.
Схема 1. Вплив різних чинників на швидкість хімічних реакцій
Каталізатори можна поділити на такі групи:
а) позитивні (прискорюють хімічні реакції). Розклад бертолетової солі під час нагрівання відбувається дуже повільно, але варто додати лише кілька крупинок каталізатора MnO2 й реакція відбувається бурхливо;
б) негативні, або інгібітори (сповільнюють хімічні реакції). Відомі інгібітори корозії. Якщо додавати уротропін, наприклад, до хлоридної кислоти, то розчинення заліза в ній значно зменшується або практично припиняється;
в) біокаталізатори – каталізатори білкової природи (ферменти), які прискорюють біохімічні процеси в живих організмах – дихання, травлення, фотосинтез.
Каталізатор може змінювати не лише швидкість хімічної реакції, але й її механізм. Специфічні каталізатори прискорюють одну реакцію, а для іншої бувають неефективними. Універсальні каталізатори змінюють швидкість різних реакцій.
Каталіз широко використовують у багатьох технологічних процесах, особливо в хімічній промисловості: виробництві амоніаку, сульфатної та нітратної кислот, барвників, у синтезі полімерів, синтетичного каучуку тощо.
Підсумок
- Швидкість хімічної реакції оцінюють, виходячи зі зміни кількості частинок речовини реагенту чи продукту реакції за одиницю часу.
- На швидкість хімічних реакцій впливають такі чинники: природа реагуючих речовин, їхня температура, концентрація, ступінь подрібненості й наявність каталізатора.
- Знаючи вплив чинників на швидкість хімічних реакцій можна прискорити бажані реакції і сповільнити небажані.
?
- Від яких чинників залежить швидкість хімічних реакцій?
- Як залежить швидкість реакції від площі реагуючих речовин?
- Як залежить швидкість реакції від температури?
- Як залежить швидкість реакції від концентрації реагуючих речовин?
- Що таке каталіз?
- Яке значення має каталіз?
- Які речовини називають інгібіторами?
- Що ми розуміємо під природою реагуючої речовини? Як вона впливає на швидкість хімічних реакцій?
- Поясніть плив каталізатора на швидкість хімічних реакцій.
Для тих, хто хоче знати хімію глибше
Швидкість хімічних реакцій
Залежність швидкості хімічної реакції від кількості частинок речовини виражається законом діючих мас.
Для реакції між речовинами А і В швидкість хімічної реакції запишемо так: υреакції = k[А] • [В]. У загальному вигляді формула хімічної реакції має такий вигляд: mA + nB = AmBn.
Закон діючих мас записують такою формулою:
υреакції = k[А]m • [В]n, де υ – швидкість реакції; [А], [В] – молярні концентрації реагуючих речовин; m, n – стехіометричні коефіцієнти; k – константа швидкості реакції.
Приклад 1
Як зміниться швидкість реакції 2NO(г) + O2(г) = 2NO2(г), якщо зменшити об’єм речовини втричі?
Розв’язання: Обидва реагенти газуваті, тому υ = k • [NO]2 • [O2]. Внаслідок зменшення об’єму концентрація кожної з речовин, що реагують, зросте втричі. Отже, υ = 3 • [NO]2 • 3[O2] = 32 • 3 = 27.
Відповідь: швидкість реакції збільшиться у 27 разів.
Приклад 2
Як зміниться швидкість хімічної реакції CH4 + 2O2 = CO2 + + 2H2O, якщо збільшити тиск у 4 рази?
Розв’язання: За законом діючих мас υ = k • [CH4] • [O2]2. Зі збільшенням тиску концентрація кожного з реагентів збільшиться в 4 рази. Звідси:
υ = 4 • [CH4] • 4[O2]2 = 4 • 42 = 64.
Відповідь: після збільшення тиску вчетверо швидкість хімічної реакції збільшиться у 64 рази.
Залежність швидкості хімічної реакції від температури визначається за рівнянням Вант-Гоффа: ![]() , де υ (t1º) і υ (t2º) – швидкість реакції за заданих температур, γ (гамма) – температурний коефіцієнт швидкості реакції, дорівнює 2-4.
, де υ (t1º) і υ (t2º) – швидкість реакції за заданих температур, γ (гамма) – температурний коефіцієнт швидкості реакції, дорівнює 2-4.
Приклад 3
У скільки разів зросте швидкість хімічної реакції із підвищенням температури від 20ºC до 40ºC, якщо температурний коефіцієнт швидкості реакції становить 3?
Розв’язання: ![]() .
.
Відповідь: з підвищенням температури з 20ºC до 40ºC швидкість реакції зросте у 9 разів.
Приклад 4
Реакція за температури 40ºC проходить за 2 хвилини 15 секунд. За який час закінчиться ця реакція за температури 60ºC, якщо температурний коефіцієнт швидкості реакції дорівнює 3?
Розв’язання: За правилом Вант-Гоффа визначимо, як зміниться швидкість реакції з підвищенням температури від 40ºC до 60ºC: ![]() .
.
Швидкість реакції зросте у 9 разів. Швидкість реакції обернено пропорційна часу, отже: ![]() , де τ(t1) і τ(t2) – час реакції за температур t1 і t2. Звідси:
, де τ(t1) і τ(t2) – час реакції за температур t1 і t2. Звідси: ![]() .
.
Враховуючи, що τ(t1) = 135 с (2 хв 15 с), визначаємо час реакції за температури t2: ![]()
Відповідь: за температури 60ºC реакція закінчиться через 15 с.
Закон діючих мас застосовують лише для гомогенних систем. Це система, яка складається з газуватих і необмежено розчинних рідких речовин.