Карбон – особливий елемент, оскільки жоден інший елемент періодичної системи хімічних елементів не здатний утворювати таке велике число сполук. Як це можливо пояснити?
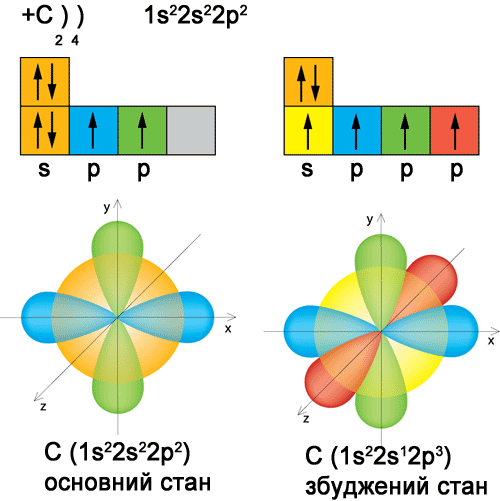
Особливості атома Карбону пояснюються його будовою. Згідно із сучасними електронними уявленнями у зовнішньому енергетичному шарі атома Карбону знаходиться чотири електрони. Він не виявляє виражену схильність віддавати або приєднувати електрони, займає проміжне становище між металічними й неметалічними елементами та характеризується різко виявленою здатністю утворювати ковалентні зв’язки. При утворенні органічних сполук атом Карбону переходить із основного стану у збуджений:
Чотири орбіталі атома Карбону, що містять неспарені електрони, дають йому можливість утворювати з іншими атомами, а також один з одним чотири ковалентні зв’язки, тобто бути чотиривалентним у органічних сполуках. Атоми Карбону здатні сполучатися один з одним утворюючи ланцюги відкритої лінійної (нормальної) будови, відкритої розгалуженої будови (ізосполуки) й замкнутої будови (циклічні сполуки). Ці ланцюжки можуть містити велику кількість атомів Карбону.
Схема 2. Схема ланцюгів утворених атомами Карбону
|
Нормальні сполуки |
Ізосполуки |
Циклічні сполуки |
Ізоциклічні сполуки |
Атоми Карбону можуть сполучатися між собою простими й кратними зв’язками (подвійними або потрійними).
Схема 3. Утворення зв’язків між атомами Карбону
|
Прості зв’язки |
Подвійні зв’язки |
Потрійні зв’язки |
| |
|
|
У кожній із таких сполук валентність Карбону рівна чотирьом. Для органічних сполук характерна гібридизація. Атом Карбону на зовнішньому енергетичному рівні має 4 валентних електрони (див. рис. 41). Один з них є 2 s–електроном, що дає кулькову конфігурацію хмарки, й три –2 p–електронами, хмарки яких у вигляді правильної вісімки розташовані під кутом 90° одна до одної. При утворенні хімічних зв’язків електронні хмарки набувають однакової форми, тобто утворюють чотири рівноцінні змішані або гібридні, хмарки у вигляді неправильної вісімки або грушовидної форми. Гібридизовані електронні хмарки взаємно відштовхуються й розташовуються у просторі так, що їх осі направлені до вершин тетраедра. Гібридизація орбіталей валентних електронів відбувається у момент утворення зв’язків, оскільки вона вигідна в енергетичному відношенні. Грушовидна форма орбіталей атома Карбону забезпечує більший ступінь перекривання електронних хмарок при утворенні ковалентного зв’язку. Молекули при цьому стають більш стабільніші.
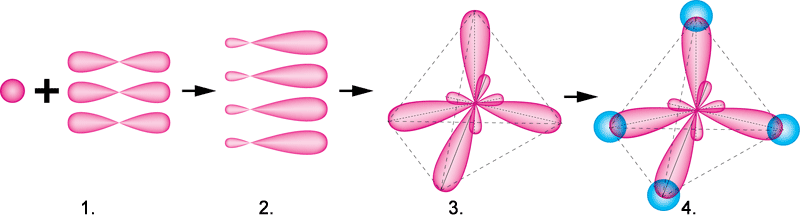
Рис. 42. Схема вирівнювання (гібридизація) s– і p–електронних хмар в атомі Карбону.
1. Взаємодія одного s– й трьох p–електронних хмар. 2. Утворення чотирьох гібридизованих хмар. 3. Розташування гібридизованих хмар в просторі. 4. Утворення молекули метану.
Між атомами Карбону можуть виникати ковалентні σ (сигма) й π (пі) зв’язки. Ковалентні зв’язки в органічних, як й у неорганічних сполуках, утворюються за рахунок перекривання s–s–, s–p–, p–p–електронних хмар.
σ–зв’язок міцний, характерні реакції заміщення.
Рис 43. Перекривання а) s–s, б) s–p, електронних хмар й утворення σ–зв’язку.
π–зв’язок слабкий, характерні реакції приєднання.
В утворенні хімічних зв’язків можуть приймати участь негібридизовані електронні хмарки p–p.
Рис 44. Перекривання p–p негібридизованих електронних хмар, утворення σ –зв’язку.
Для органічних сполук характерне явище ізомерії.
Наприклад, при наявності в молекулі органічної сполуки чотирьох атомів Карбону можлива ізомерія у результаті різного розміщення атомів Карбону. С4Н10 бутан існує у вигляді двох ізомерів:
СН3–СН2–СН2–СН3 н–бутан, tк +0,6°С
![]() , ізобутан, tк +11,7°С.
, ізобутан, tк +11,7°С.
В органічній хімії тепер застосовують емпіричні, структурні, напівструктурні та електронні формули. Емпіричні формули відображають якісний склад молекули та кількість атомів у ній.
Структурні та електронні формули відображають порядок з’єднання атомів у молекулі. Ковалентний зв’язок позначається рисочкою (−). Кожна рисочка означає загальну пару електронів, яка зв’язує атоми між собою. В органічній хімії звичайно користуються структурними формулами, оскільки атоми мають просторове розміщення у молекулі. Структурні формули – це мова органічної хімії. Іноді, для того, щоб показати природу хімічного зв’язку та пояснити механізм реакції, користуються електронними формулами, у яких ковалентний зв’язок позначають парою крапок (··).
Схема 4. Формули сполук
|
Сполука |
Емпірична формула |
Структурна формула |
Напівструктурна формула |
Електронна формула |
|
Етилен |
С2Н4 |
Часто показують напрям зміщення пари електронів у молекулі. Структурна формула хлороцтової кислоти має такий вигляд:
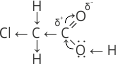
Підсумок
- Атом Карбону є чотиривалентним.
- Атоми Карбону можуть сполучатися один з одним й утворювати ланцюги, затрачаючи на взаємний зв’язок по одній, по дві або по три одиниці валентності.
- Карбонові ланцюги можуть бути лінійними, розгалуженими або замкнутими.
- Структурні формули відображають порядок з’єднання атомів у молекулі.
- Здатність атомів Карбону сполучатися між собою та з іншими елементами в різному порядку зумовлює явище, яке дістало назву ізомерії.
?
- Як розміщені електрони за енергетичними рівнями й підрівнями в атомі Карбону? Що таке збуджений й незбуджений стан атома?
- Як ви можете пояснити збуджений стан атома Карбону?
- Яка валентність атому Карбону?
- Що таке ізомерія?
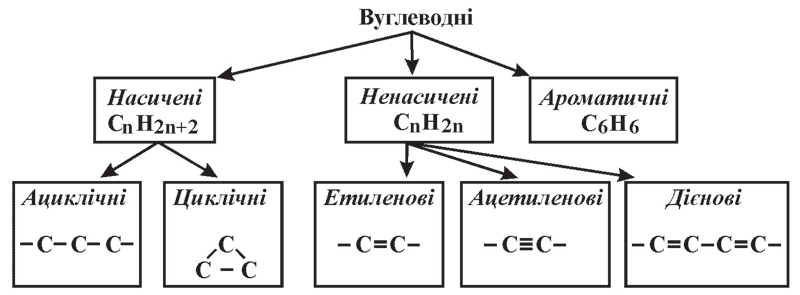
Вуглеводні
Таблиця 6. Класифікація вуглеводнів
Насичені вуглеводні за міжнародною номенклатурою називають алканами. Порівняно з іншими вуглеводнями вони менш активні, тому їх називають парафінами (лат. parrum affinis – «пасивний»). У молекулах насичених вуглеводнів атоми Карбону зв’язані між собою простим (одинарним) зв’язком, а решта валентностей – насичені атомами Гідрогену. Першим членом гомологічного ряду є метан.