Щоб глибше зрозуміти природу розчинів, порівняємо розчинення з випаровуванням. Під час випаровування, так само як і під час розчинення, відбувається дроблення речовини на молекули, тобто порушується зв’язок між частинками речовини, що випаровується. На це витрачається енергія, тому випаровування завжди супроводжується охолодженням: випаровування відбувається за рахунок кінетичної енергії теплового руху молекул.
Чи не відбувається подібне під час розчинення? Перевірити це можна на досліді. З помітним навіть на дотик охолодженням розчиняється у воді багато солей, у тому числі кухонна сіль. Розчинення у воді деяких солей супроводжується дуже великим зниженням температури. Так, якщо розчиняти у воді амоній хлориду в тонкостінній склянці, яка стоїть на мокрій дощечці, то поглинається стільки тепла, що склянка примерзає до дощечки.
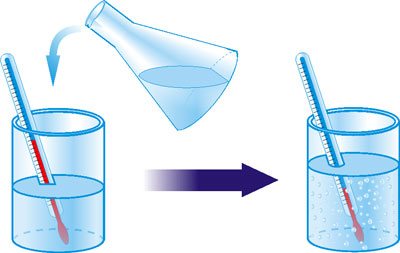
Рис. 16. Розчинність NH4Cl у воді
Проте в інших випадках під час розчинення речовин тепло не поглинається, а навпаки виділяється. Так, під час розчинення у воді сульфатної кислоти виділяється стільки тепла, що вода може закипіти.
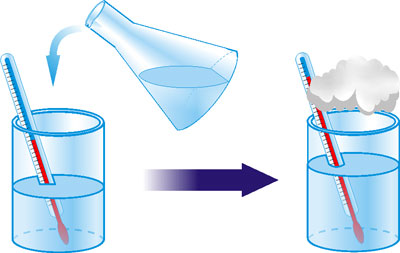
Рис. 17. Розчинність H2SO4 у воді.
Таким чином, в одних випадках тепло під час розчинення виділяється, в інших – вбирається. Це показує, що розчинення не зводиться тільки до розподілу частинок однієї речовини між частинками (молекулами) іншої, а супроводжується хімічною взаємодією частинок розчинюваної речовини з частинками (молекулами) розчинника. Ця взаємодія в одних випадках виявляється більшою мірою, в інших – меншою.
Процес розчинення – це взаємодія частинок розчиненої речовини з молекулами розчинника, який супроводжується виділенням або поглинання теплоти.
Голандський хімік Я. Х. Вант-Гофф і німецький хімік В. Оствальд довели дифузію газів. Шведський учений С. А. Арреніус (1859 – 1927) довів наявність фізичного процесу дифузії у розчинах. Підтвердженням цього є рівномірне забарвлення розчинів під час розчинення забарвлених речовин.
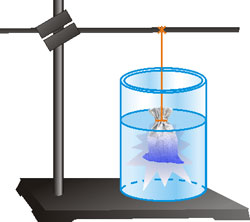
Рис.18. Дифузія купрум (ІІ) сульфату.
Д. І. Менделєєв створив хімічну теорію розчинів. Згідно з цією теорією під час розчинення утворюються сольвати – нестійкі хімічні сполуки розчиненої речовини з розчинником (у разі водних розчинів – гідрати). Особливо схильні до гідратації йони. Йони приєднують полярні молекули води, в результаті утворюються гідратовані йони. Багато з таких гідратованих йонів неміцні й легко розкладаються.
Якщо, наприклад, кухонну сіль помістити у воду, то можна помітити, як маса твердої речовини поступово зменшується. У процесі розчинення молекули води притягуються своїми негативними полюсами до позитивно заряджених йонів натрію, а позитивними полюсами – до негативно заряджених хлорид-іонів. У результаті цього зв’язок між йонами в солі послаблюється й кристалічна решітка руйнується. У розчині утворюються тимчасові сполуки гідрат-іони Натрію та гідрат-іони Хлору.
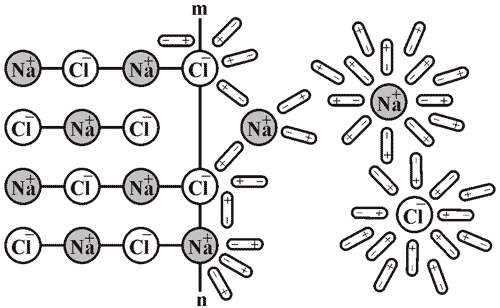
Рис. 19. Схема розчинення натрій хлориду у воді (m-n – поверхня кристалу).
А – розпад на іони (іонізація). Теплота поглинається на руйнування зв’язків.
Б – гідратація з утворенням гідрат-іонів. При утворенні гідратів виділяється теплота.
Іонізація – це процес розпаду речовини на йони під дією полярного розчинника.
Гідратація – це процес утворення гідрат-іонів.
Гідрат-іон – це іон оточений диполями води.

І.О. Каблуков (1857 – 1942). Радянський учений, академік. Запровадив уявлення про гідратацію йонів, започаткував фізичну й хімічну теорію розчинів.
Чому під час розчинення речовин в одних випадках спостерігається розігрівання, а в інших – охолодження? Це пояснюється тим, що при зв’язуванні частинок речовини, що розчиняється, з молекулами розчинника виділяється енергія (при утворенні зв’язків у гідрат-іонах), а при руйнуванні зв’язків між йонами кристалу солі, теплота поглинається. Якщо теплоти виділяється більше, ніж витрачається на розрив зв’язків між частинками речовини, що розчиняється, то розчинення супроводжується нагріванням. Якщо теплоти виділяється менше при утворенні гідрат-іонів, необхідна енергія вбирається ззовні й відбувається охолодження. За цією ознакою процес розчинення слід віднести до фізичних явищ. Як ви знаєте, виділення теплоти – це ознака хімічної реакції. Отже, під час розчинення здійснюються й хімічні реакції. Наприклад, молекули сульфатної кислоти реагують з молекулами води й утворюються сполуки складу: Н2SO4•H2О (моногідрат сульфатної кислоти) і Н2SO4•2H2О (дигідрат сульфатної кислоти).
Взаємодію молекул сульфатної кислоти з молекулами води відносять до реакцій гідратації, а речовини, що при цьому утворюються, називають гідратами.
Залежно від співвідношення теплових ефектів процес розчинення речовини може бути екзо- або ендотермічним. Якщо:
|
Q іонізації = Q гідратації Q іонізації < Q гідратації Q іонізації > Q гідратації |
t° розчину не зміниться. розчин нагрівається (екзотермічний процес). розчин охолоджується (ендотермічний процес). |
Отже, процес розчинення – це фізико-хімічний процес
Існує дві точки зору на природу розчинів: фізична і хімічна. Згідно з першою, розчини розглядалися як механічні суміші, а згідно з другою – як нестійкі хімічні сполуки молекул розчиненої речовини і розчинника. Останню точку зору висловив у 1887 р. Д. І. Менделєєв.
Поняття про кристалогідрати
Кількість молекул води у формульній одиниці кристалогідрату не пов’язана з валентністю елементів
Через деякий час після розчинення гідрат-іони руйнуються, однак деякі йони так міцно утримують біля себе диполі води, що в такому стані можуть зберігатися навіть після нагрівання, утворюються кристалогідрати.
Кристалічні речовини, до складу яких входять певне число молекул води, називають кристало-гідратами.
Вода, яка входить до складу кристалів, називається кристалізаційною водою.
У тому, що між частинками розчиненої речовини і молекулами розчину відбувається взаємодія, переконаємося на досліді. Якщо в пробірку до білого порошку купрум (II) сульфату долити трохи води, спостерігається сильне нагрівання розчину, а порошок із білого стає блакитним.
Якщо цей розчин випарувати досуха, то замість білого порошку утворюється у вигляді кристалів інша речовина – мідний купорос. Хімічний аналіз показує, що у мідному купоросі кожна молекула купрум сульфату зв’язана з п’ятьма молекулами води, тому склад мідного купоросу зображується формулою CuSO4 • 5H2O.
CuSO4 + 5H2O → CuSO4 • 5H2О
При прожарюванні мідного купоросу вода з нього виділяється і знов утворюється купрум (II) сульфат:
CuSO4 • 5H2O → CuSO4 + 5H2O. Кількість молекул води у формульній одиниці кристалогідрату не пов’язана з валентністю елементів.

Рис 20. Виділення кристалізаційної води при нагріванні мідного купоросу.
|
Приклади деяких кристалогідратів |
|
|
CuSO4 • 5H2O – купрум сульфат. пентагідрат; мідний купорос |
Na2СO3 • 10H2O – натрій карбонат, декагідрат |
|
FeSO4 • 7H2O – ферум сульфат, гептагідрат; залізний купорос |
MgSO4 • 6H2O – магній сульфат, гексагідрат; гірка сіль |
|
CaSO4 • 2H2O – гіпс |
BaCl2 • 2H2O – барій хлорид, дигідрат |
|
Na2SO4 • 10H2O – глауберова сіль |
SnCl2 • 2H2O – станум (II) хлорид, дигідрат |
|
CuCl2 • 2H2O – купрум (II) хлорид, дигідрат |
NiSO4 • 7H2O – нікель сульфат, гептагідрат |
|
Ca(NO3)2 • 4H2O – кальцій нітрат, тетрагідрат |
FeCl3 • 6H2O – ферум (III) хлорид, гексагідрат |
Підсумок:
- Для прискорення процесу розчинення збільшують площу стикання між розчинником і речовиною. Для цього речовину подрібнюють і перемішують.
- Процес розчинення можна розглядати як сукупність таких фізико-хімічних процесів:
|
Хімічний процес |
|
|
Фізичний процес |
|
?
- Як і чому під час розчинення речовин у воді може змінюватися температура розчинів?
- Як ви розумієте процес гідратації?
- Що таке кристалогідрати?
- Який хімічний процес відбувається при розчиненні речовин у воді?
Експериментуємо
Хімічний «хамелеон»
Помістіть в пробірку суху сіль кобальт хлориду і добавте невелику кількість безводного ацетону. Вміст перемішайте. Сіль і шар ацетону набуде синього кольору. Добавте воду. Розчин набуде рожевого кольору. Суть досліду у тому, що ацетон поглинає воду з кристалогідрату, кристалогідрат руйнується. Безводна сіль, яка при цьому утвориться має синє забарвлення. Якщо добавити воду, відбувається зворотний процес – утворення кристалогідрату:
CoCI2 • 6H2O (рожевий кристалогідрат) ⇄ CoCI2 (синя безводна сіль) + 6H2O
Цей дослід показує, що кристалогідрати утримують воду по-різному. Наприклад, якщо добавити ацетон до мідного купоросу, зміни кольору не відбудеться, тому що мідний купорос більш стійкий.



















1 коментар
Наталія Володимирівна
Інформація змістовна і лаконічна) Дякую за “Приклади деяких кристалогідратів”.