Реакції екзотермічні та ендотермічні
Відомо, що одні хімічні реакції для свого перебігу потребують нагрівання, а інші відбуваються навіть при глибокому охолодженні. Інколи хімічні перетворення спричиняються опроміненням реагентів світлом, а інколи супроводжуються виділенням великої кількості світла й тепла. Вам відомі реакції горіння, які супроводжуються виділенням теплоти і світла, наприклад, горіння вугілля. Існує чимало інших реакцій, під час яких виділяється теплота. Так, під час взаємодії кальцій оксиду з водою (гашення вапна) виділяється значна кількість теплоти:
CaO + H2O = Ca(OH)2 + Q;
C + O2 = CO2 + Q.
В екзо-термічних реакціях теплота виділяється. В ендотермічних реакціях теплота поглинається.
Теплота виділяється також під час реакцій між кислотою і лугом.
Хімічні реакції, які відбуваються з виділенням теплоти, називають екзотермічними (від грецького «екзо» – «назовні»).
Існують реакції, під час яких теплота поглинається. Для виникнення та перебігу таких реакцій потрібне нагрівання. Наприклад, вапняк перетворюється в палене вапно у процесі безперервного нагрівання, розклад калій перманганату, в результаті якого добувають кисень, теж відбувається під час нагрівання:
2KMnO4 = K2MnO4 + MnO2 + O2 – Q.
Хімічні реакції, які відбуваються з поглинанням теплоти, називають ендотермічними (від грецького «ендо» – «всередину»).
Щоб показати виділення або поглинання теплоти, в хімічному рівнянні після формул продуктів реакції дописують Q:
- «+ Q» (якщо теплота виділяється);
- «– Q» (якщо теплота поглинається).
Тепловий ефект реакцій
Нерідко хімічні реакції використовують на практиці не заради речовин, які утворюються при цьому, а заради енергії, що утворюється під час її перебігу. З давніх давен люди почали обігрівати своє житло, спалюючи деревину, рослинні залишки та інше. В останні десятиліття для цього використовують вугілля, нафту, природний газ.
Кількість теплоти, яка поглинається або виділяється під час хімічних реакцій, називають тепловим ефектом реакції (позначається: ΔH («дельта-аш»)).
Хімічні рівняння, в яких вказується тепловий ефект, називають термохімічними.
З курсу фізики вам відомо, що одиницею вимірювання кількості теплоти служить джоуль (Дж) і вимірюють її калориметром. Якщо спалити в калориметрі 1 г вуглецю і виміряти кількість теплоти, що виділилась, то отримаємо 34,17 кДж. В перерахунку на молярну масу вуглецю (12 г) отримаємо:
34,17 кДж/г • 12 г/моль ≈ 410кДж/моль.
Припишемо цю величину як доданок до правої частини рівняння:
С + О2 = СО2 + 410 кДж.
Знак «+» перед величиною теплового ефекту означає, що теплота виділяється (реакція екзотермічна). Якщо реакція ендотермічна, величину теплового ефекту вводять в ліву частину рівняння або переносять у праву його частину зі знаком «–». Так, рівняння реакції розкладу води запишемо:
2Н2О + 671,6 кДж = 2Н2 + О2, або 2Н2О = 2Н2 + О2 – 671,6 кДж.
У чому ж причина виділення або поглинання теплоти під час хімічної реакції?
Суть хімічних реакцій зводиться до розриву хімічних зв’язків у реагентах і утворення їх у продуктах реакцій. При цьому загальна кількість атомів кожного елемента до і після реакції не змінюється. Утворення хімічних зв’язків супроводжується виділенням певної кількості енергії, а розрив – її поглинанням. Якщо зв’язки між атомами у вихідних речовинах слабкіші, ніж між атомами у продуктах реакції, то енергія виділяється, і навпаки.
Наприклад, реакція синтезу гідроген хлориду екзотермічна:
Н–Н + Н–Сl = 2Н–Сl + 184,6 кДж.
Під час утворення 2 моль НСl виділяється 862,8 кДж енергії. На розрив зв’язку Н–Н витрачається 435,9 кДж/моль, а на розрив зв’язку Н–Сl – 242,3 кДж/моль. Різниця становить 862,8 – (435,9 + 242,3) = 184,6 (кДж), яка виділяється у вигляді тепла. Цю різницю називають тепловим ефектом реакції (ΔH).
Якщо реакція екзотермічна (супроводжується виділенням теплоти), то вміст енергії у вихідних речовинах більший, ніж у продуктах реакції, теплота виділяється в навколишнє середовище й енергія реакційної системи зменшується, тоді тепловий ефект ΔH буде негативним.
Для ендотермічних реакцій вміст енергії у вихідних речовинах менший, ніж у добутих продуктах, теплота надходить іззовні у систему, енергія системи збільшується, тепловий ефект ΔH буде позитивний.
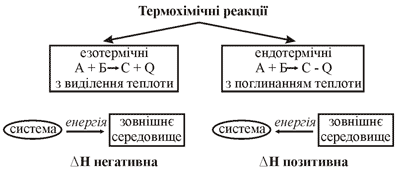
Рис. 39. Класифікація термохімічних реакцій.
Тепловий ефект реакції (ΔH) – це різниця між вмістом енергії у вихідних реагентах і кінцевих продуктах реакції.
Тепловий ефект реакції записують окремо від хімічного рівняння, після крапки з комою:
2Mg + O2 = 2MgO; ΔH = –1205 кДж (екзотермічна);
C + H2O = CO + H2; ΔH = +131,4 кДж (ендотермічна).
Тепловий ефект реакції визначають для речовини кількістю 1 моль, тому в термохімічному рівнянні допускається і дробовий коефіцієнт:
H2 + 0,5O2 → H2O + 285,8 кДж.
Енергію, яка виділяється або поглинається під час хімічної реакції, називають хімічною енергією. Хімічна енергія реакції може перетворюватися на теплову, променеву, механічну або електричну і навпаки. Виділення або поглинання теплоти під час реакції узгоджується з принципом збереження енергії: енергія не виникає з нічого і не зникає безслідно, а лише перетворюється з одного виду в інший. Користуючись термохімічними рівняннями, можна проводити різні обчислення.
Підсумок:
- Реакції, під час яких теплота виділяється, називають екзотермічними, а реакції, під час яких теплота поглинається, називають ендотермічними.
- Галузь хімії, яка досліджує теплові ефекти під час хімічних реакцій, називається термохімією.
- Кількість теплоти, яка поглинається або виділяється під час хімічних реакцій, називають тепловим ефектом реакції (позначається: ΔH («дельта-аш»)).
- Усі реакції проходять з певним тепловим ефектом: або з виділенням теплоти, або з її поглинанням. Якщо кількість теплоти є незначною, то помітити тепловий ефект реакції досить важко.
?
- Які рівняння називають термохімічними?
- Що таке тепловий ефект реакції?
- Які реакції називають екзотермічними?
- Які реакції називають ендотермічними?
- Що позначає величина ΔH? Як ви розумієте її фізичний зміст?
- Поясніть, чому одні хімічні реакції супроводжуються виділенням теплоти, а інші – поглинанням?
Для тих, хто хоче знати хімію глибше
За термохімічним рівнянням можна визначити, яка кількість теплоти виділиться в тій чи іншій реакції, а також скласти термохімічне рівняння реакції.
Визначення кількості теплоти за термохімічним рівнянням
Приклад 1. За термохімічним рівнянням: S+ O2 = SO2 + 297 кДж, обчисліть кількість теплоти, яка виділиться у процесі згоряння сірки, маса якої 1 кг.
|
Дано: |
Розв’язання: |
|
Q – ? |
Під час згоряння 1 моль сірки виділяється 297 кДж енергії, а під час згоряння 1000 г – х кДж. Звідси:
![]()
![]()
Відповідь: у процесі згоряння 1 кг сірки виділиться 9281 кДж енергії.
Складання термохімічних рівнянь
Приклад 2. Під час взаємодії заліза масою 7 г із сіркою виділилось 12,15 кДж теплоти. Складіть термохімічне рівняння.
|
Дано: |
Розв’язання: |
|
Термохімічне рівняння – ? |
![]()
![]()
Відповідь: термохімічне рівняння Fe + S = FeS + 97,2 кДж.
Тепловий ефект прямої реакції дорівнює тепловому ефекту зворотної реакції, але з протилежним знаком.
Приклад 3. У результаті реакції сульфур (IV) оксиду кількістю речовини 3 моль з достатньою кількістю кисню утворюється сульфур (VI) оксид і виділяється 297 кДж теплоти. Складіть термохімічне рівняння розкладу сульфур (VI) оксиду на сульфур (IV) оксид і кисень. Екзотермічною чи ендотермічною є друга реакція?
| Дано: ν(SO2) = 3 моль Q= 297 кДж |
Розв’язання: 1. Записуємо рівняння першої реакції і обчислюємо тепловий ефект цієї реакції: 2. Термохімічне рівняння реакції сульфур (IV) оксиду з киснем має вигляд: 3. Записуємо термохімічне рівняння зворотної реакції: |
| Термохімічне рівняння – ? |
Відповідь: 2SO3 = O2 + 2SO3 –198 кДж, реакція ендотермічна.

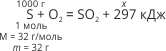
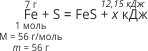


















1 коментар
mishana
Під час утворення 2 моль НСl виділяється 862,8 кДж енергії. На розрив зв’язку Н–Н витрачається 435,9 кДж/моль, а на розрив зв’язку Н–Сl – 242,3 кДж/моль. Різниця становить 862,8 – (435,9 + 242,3) = 184,6 (кДж), яка виділяється у вигляді тепла. Цю різницю називають тепловим ефектом реакції (ΔH).
Тут опечатка “На розрив зв’язку Н–Н витрачається 435,9 кДж/моль, а на розрив зв’язку Н–Сl – 242,3 кДж/моль.”