Роль води як розчинника у живій природі
Воду, яка містить велику кількість солей кальцію і магнію, називають твердою.
Природна вода не буває чистою, тому що вона здатна розчиняти багато речовин. У прісних водах міститься від 0,01 до 0,1% домішок. Морська вода містить 3,5% розчинених речовин або 80 елементів періодичної системи. В 1 кг морської води знаходиться 35 г різних солей, у найбільшій кількості міститься NaCl.
Загальний вміст солей в світовому океані – 5 • 1016 т.
Серед них:
Na+ – 30,6% Ca2+ – 1,2% Cl– – 55,2%
Mg2+ – 3,7% K+ – 1,1% SO42– – 7,7%

Морська вода – це суміш речовин
Багато погано розчинних солей осідає на дно океану. Щорічно осідає біля 2300 млн. т. солей, головна частина яких – CaCO3. У результаті утворюються поклади крейди й вапняку.
Дощова вода розмиває гігантські масиви ґрунту і відносить його в ріки, озера, моря. Озера, багаті розчинами солей, є сировинними базами для розвитку хімічного виробництва.
Вода відіграє важливе значення в житті рослин, тварин і людини. Вона є тим середовищем, в якому проходять хімічні процеси, які забезпечують життєдіяльність організмів. Крім того, вона сама приймає участь у великій кількості біологічних реакцій, таких, як здатність поглинати і виділяти у зовнішнє середовище речовини, збереження певної форми клітин, підтримання тургору.
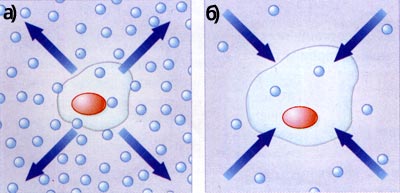
Якщо концентрація солей у клітині менша, ніж в навколо клітинному просторі, вода з клітини виходить (а); якщо більша – вода в неї входить (б)
Рослини засвоюють необхідні для росту й розвитку речовини також у вигляді розчинів.
Лікувальні властивості мінеральної води залежать від якісного і кількісного складу розчинених у ній речовин.
Взаємодіючи з різними породами, вода утворює мінерали. Вода впливає на формування клімату Землі, регулює склад повітря, бере участь у формуванні поверхні Землі. Водні розчини мають важливе значення в усіх сферах людської діяльності.
Будова молекули води
Як вам відомо, в молекулі води зв’язки між атомами Гідрогену й атомом Оксигену ковалентні полярні. Спільні електронні пари зміщені до атома Оксигену, тому на атомах Гідрогену зосереджений частково позитивний, а на атомі Оксигену – частково негативний заряд:
![]()
В атома Гідрогену один неспарений s-електрон. На зовнішньому енергетичному рівні атома Оксигену – два неспарені p-електрони, орбіталі яких взаємно перпендикулярні:
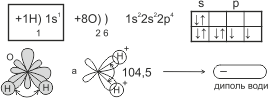
При утворенні молекули води орбіталі p-електронів атома Оксигену перекриваються орбіталлю s-електрона атома Гідрогену – вздовж лінії координат, утворюючи кут між зв’язками 104,5°. Позитивні і негативні заряди розташовані нерівномірно і знаходяться на протилежних кінцях молекули, тому молекула води має два полюси і є диполем.
Між атомами Оксигену і Гідрогену в молекулі води виникають міцні зв’язки, тому розкласти молекулу на атоми можна лише за допомогою електричного струму. Оскільки атоми Оксигену набувають частково негативного заряду, то вони можуть взаємодіяти з атомами Гідрогену іншої молекули води, які мають частково позитивний заряд. Такий зв’язок називається водневим. Наприклад, це спостерігається в кристалі льоду, де кожна молекула води тетраедрично сполучена водневими зв’язками з чотирма найближчими до неї молекулами:
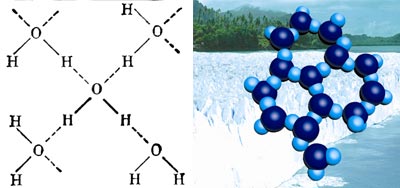
Структура льоду.
Світлі кружечки – атоми Гідрогену, темні – атоми Оксигену
Вода складається з полярних молекул (диполів).
Оскільки водневий зв’язок довший від ковалентного зв’язку, структура льоду є рихла. Цим пояснюється невелика густина льоду. Міцність водневого зв’язку приблизно в 10 разів менша звичайного ковалентного зв’язку. З підвищенням температури водневий зв’язок легко розривається. Цим пояснюється перехід води із твердого стану в рідкий.
Утворенням водневих зв’язків між молекулами спирту і води пояснюється хороша розчинність спирту у воді.
Підсумок:
- Водні розчини мають важливе значення в усіх сферах людської діяльності.
- В молекулі води заряди ядер атомів Оксигену й Гідрогену різні і по-різному притягують орбітальні електрони. В результаті молекулярні орбіталі зміщуються в напрямку ядра, що має більший позитивний заряд і молекула набуває полярності (перетворюється в диполь).
- Водневий зв’язок має істотне значення у багатьох хімічних процесах.
Для допитливих
♦ Вода вкриває близько 3/4 всієї земної поверхні. 98% загальної кількості води міститься в морях і океанах. В цій воді є багато солей, тому вона не придатна для зрошення, пиття та для багатьох інших потреб. Запаси прісної води, яка необхідна для життя і технічних потреб, становлять лише 2% загальної кількості води. Воду використовують для зрошення, для виробництва дешевої електричної енергії, в техніці як розчинник і реагент у різних хімічних процесах, для охолодження тощо.
♦ Живі організми містять значну кількість води. Так, людське тіло майже на 70% складається з води. Одне доросле дерево забирає з ґрунту і випаровує близько 50-70 відер води на добу.
♦ Близько 20% сонячної енергії, яку отримує Земля, витрачається на випаровування води. Вода має найбільшу теплоємність. Одержане тепло вона віддає в навколишній простір, що значною мірою впливає на клімат.
?
- Яка роль води як універсального розчинника в природі?
- Що таке диполь води?
- Що таке водневий зв’язок?


















