Соли азотной кислоты называют нитратами. Нитраты щелочных металлов, кальция и аммония еще называют селитрами, например: KNO3 – калиевая селитра; NaNO3 – натриевая (чилийская) селитра; Ca(NO3)2 – кальциевая (норвежская) селитра; NH4NO3 – аммиачная селитра.
Все нитраты – твердые кристаллические вещества, хорошо растворимые в воде, малоустойчивые при высокой температуре. В отличие от хлоридов, которые плавятся, не разлагаясь, нитраты разлагаются при температуре близкой к температуре их плавления. Продукты разложения бывают разные, в зависимости от химической активности металла, входящего в состав соли. Разложение нитратов можно изобразить схемой:
Разложение нитратов при нагревании
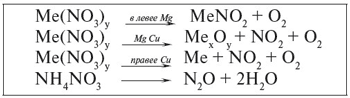
Например:
1. Соли металлических элементов до Mg при разложении образуют нитриты и кислород:
2NaNO3 → 2NaNO2 + O2.
2. Соли металлических элементов от Mg до Cu при разложении образуют основной оксид, нитроген(IV) оксид и кислород:
2Cu(NO3)2 → 2CuO + 4NO2 + O2.
3. Соли металлических элементов расположенных в ряду активности металлов после Cu образуют металл, нитроген оксид и кислород:
2AgNO3 → 2Ag + 2NO2 + O2.
Лабораторный опыт 6. Ознакомление с образцами нитратов и солей аммония
Ознакомьтесь с выданными вам образцами солей нитратной кислоты и аммония. Выясните цвет, растворимость в воде, запах. Полученные результаты запишите в таблицу:
| Название соли | Формула соли | Цвет | Запах | Растворимость в воде |
Качественная реакция на нитрат-ион
Нитратная кислота и нитраты содержат нитрат-ион NO3–. Для определения нитрат-иона NO3– в пробирку помещают немного исследуемого вещества, добавляют медных опилок, вливают концентрированную серную кислоту и нагревают. Выделение бурого газа NO2 свидетельствует о наличии нитрат-ионов.
Схематически это можно изобразить так:
![]()
Например:
KNO3 + H2SO4 → KHSO4 + HNO3(k)
4HNO3 + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O
Применение нитратов
- Нитраты используют преимущественно как удобрения.
- Нитраты щелочных металлов используют как компоненты ракетного топлива.
- KNO3 используют для производства черного пороха.
- KNO3, NaNO3 – в малых количествах используют для производства мясных продуктов, некоторых сортов сыра (придают мясным продуктам красно-коричневый цвет).
- AgNO3 — для производства зеркал, в гальванотехнике, в аналитической химии, небольшие дозы в медицине как вяжущее и бактерицидное средство.
- Ba(NO3)2, Sr(NO3)2, Pb(NO3)2 – в пиротехнике.
Проблема содержания нитратов в пищевых продуктах
Из-за применения интенсивных технологий выращивания растений, которые предусматривают использование большого количества минеральных удобрений, нитраты накапливаются в продуктах. Много нитратов в колбасах, молоке, 80% нитратов попадает в организм из растений. Их больше в ранних овощах, овощах защищенного грунта. Высокое содержание нитратов содержит редис, редька, дыни, кабачки, яблоки, свекла.
Сами нитраты не ядовиты, но в организме они превращаются в ядовитые вещества – нитриты, которые взаимодействуют с гемоглобином крови окисляя Fe2+ до Fe3+. Вместо гемоглобина образуется метгемоглобин, который теряет красную окраску и приобретает темно-коричневый цвет. Метгемоглобин не способен переносить кислород. Возникает кислородная недостаточность, нарушается тканевое дыхание. Как следствие возникают эрозивные гастриты, нарушения деятельности щитовидной железы, сердечно-сосудистой системы. Кроме того, под действием нитритов в организме образуются канцерогенные вещества, вызывающие онкологические заболевания. Наиболее чувствительны к нитритам дети, больные и люди старшего возраста.
Уменьшить количество нитратов можно, если овощи, плоды перед употреблением тщательно промыть горячей водой, после чего яблоки, огурцы почистить, а из моркови вырезать сердцевину. Снижению вредного воздействия на организм нитратов и нитритов способствует употребление витаминов, особенно А, Е, В9.
Содержание нитратов можно определить индикаторной бумагой ДФА (дифениламина) по следующей шкале:
| Окраска бумаги ДФА | Содержание нитратов |
| ярко-синий | очень высокое |
| синий | високое |
| светло-синий | среднее |
| голубой | низкое |
| светло-голубой | отсутствует |

















