Формула угольной (карбонатной) кислоты – Н2СО3.
Солеобразующий оксид СО2 растворяясь в воде образует слабую кислоту, которая существует только в момент ее образования. Кислота не устойчива и сразу разлагается на углекислый газ и воду:
Н2СО3 ⇄ СО2↑+ Н2О.
Как двухосновная, она диссоциирует ступенчато. Сначала Н2СО3 ⇄ Н+ + НСО3–, а дальше у невеликій кількостіа далее в небольшом количестве НСО3– ⇄ Н+ + СО32–.
Ступінь дисоціації низький.
Внаслідок нестійкості молекул карбонатної кислоти її не можливо виділити в чистому вигляді. Якщо воду під тиском наситити вуглекислим газом, то добувають газовану воду. Газована вода – це і є водний розчин вугільної кислоти. Коли пляшку з газованою водою відкрити, тиск зменшується і вуглекислий газ у вигляді бульбашок виходить з води, тобто кислота розкладається. В момент її утворення вона взаємодіє з оксидами й гідроксидами лужних і лужноземельних металів.
Хімічні властивості карбонатної кислоти
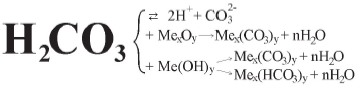
Карбонатна кислота в момент її утворення взаємодіє з активними металами, основними оксидами, лугами. При надлишку кислоти з лугами утворюється кисла сіль.
Наприклад:
H2CO3 + Mg → MgCO3 + H2
H2CO3 + CaO → CaCO3 + H2O
H2CO3 + 2NaOH → Na2CO3 + 2H2O
H2CO3 + NaOH → NaHCO3 + H2O
У природних умовах розчинений вуглекислий газ входить до складу мінеральної води. Дощова вода з вмістом СО2 повільно розчиняє мармур, пам’ятники, прискорює корозію. Розчиняючи вапнякові породи до кислих солей сприяє утворенню печер.
Карбонати
Карбонатна кислота утворює два ряди солей: середні та кислі.
| Кислота | Кислотний залишок | Характер солі | Склад солі, назва | Приклад |
| Н2СО3 | − НСО3 | кисла | Me(HCO3)у гідрогенкарбонати |
NaHCO3 – натрій гідрогенкабонат Ca(HCO3)2 – кальцій гідрогенкабонат |
| = СО3 | середня | Meх(CO3)у карбонати |
Na2CO3 – натрій карбонат CaCO3 – кальцій карбонат |
Солі карбонатної кислоти – кристалічні речовини, сполуки стійкі, хоча сама кислота не стійка. Їх можна добути взаємодією вуглекислого газу з лугом. Реакцію можна зобразити такою схемою:
| MeOH + CO2 = Meх(CO3)у + Н2О MeOH + CO2 = MeНCO3 |
Наприклад:
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Карбонати лужних металів і амонію, гідрокарбонати розчиняються у воді. Карбонати інших металів у воді не розчиняються. Карбонати хрому, феруму(ІІІ), купруму, меркурію не існують.
У природі найпоширеніший кальцій карбонат СаСО3 у вигляді вапняка, крейди та мармуру.
Хімічні властивості карбонатів
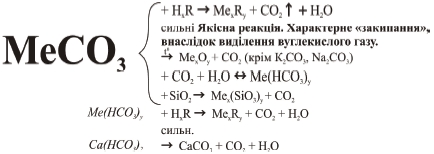
1. Відношення до нагрівання:
Карбонати лужних металів стійкі до нагрівання. Карбонат кальцію, магнію, малоактивних металів розкладаються при нагріванні: СаСО3 → СаО + СО2.
2. Взаємодія з кислотами:
При взаємодії карбонатів із сильними кислотами спостерігається сильне спінювання розчину внаслідок виділення вуглекислого газу: СаСО3 + 2НCl = СаCl2 + Н2О + СО2. Цю реакцію використовують, щоб розпізнати карбонати серед інших речовин.
Лабораторний дослід 8. Дослідження властивостей карбонатів
Дослід 1. Взаємодія питної соди з оцтовою кислотою.
В пробірку налийте 1-2 мл оцтової кислоти і добавте трішки соди. Спостерігайте виділення газу. Напишіть рівняння реакції. Який газ виділяється?
Дослід 2. Якісна реакція на карбонати.
Налийте в пробірку натрій карбонат і долийте 1 мл розчину хлоридної кислоти. Що спостерігаєте? Напишіть повне та скорочене йонні рівняння.
3. Гідрокарбонати лужних металів перетворюються на карбонати:
2NаНСО3 → Nа2СО3 + СО2 + Н2О, інші – на оксиди: Mg(НСО3)2 → MgО + 2СО2 + Н2О.
4. Якщо через водний розчин натрій карбонату або кальцій карбонату пропустити вуглекислий газ, то карбонати перетворюються на гідрокарбонати: СаСО3 + СО2 + Н2О = Са(НСО3)2.
Застосування
- Деякі карбонати широко використовуються в промисловості.
- Na2CO3 (кальцинова сода) – у виробництві скла, мила, паперу, у побуті як миючий засіб, у нафтовій промисловості.
- CaCO3 – як будівельний матеріал і як вихідний продукт для добування вапна. Мелена крейда як наповнювач для ґумових сумішей, паперу, лінолеуму, зубного порошку. Мармур – для виготовлення скульптур, у будівництві.
- MgCO3 – для добування MgO і чистого CO2, який використовується для виробництва штучних мінеральних вод.
- K2CO3 (поташ) – виробництво мила, скла, як калійне добриво.
- NaHCO3 (питна сода) – у кондитерській справі, для виготовлення штучних мінеральних вод, у вогнегасниках, у медицині, у фотосправі.
- NH4HCO3 (амоніяк) – у кондитерській справі, для фарбування тканин, у медицині.
- PbCO3 – для виготовлення свинцевого білила. Фарба дає міцне покриття, зокрема для кораблів, але дуже отруйна.
- Cu2(OH)2CO3 (малахіт) – для виготовлення зелених фарб, ювелірних виробів, у піротехніці.
Практична робота 1. Добування карбон(IV) оксиду. Взаємоперетворення карбонатів і гідрогенкарбонатів
Прилади і реактиви: прилад для добування газів, газовідвідна трубка з корком, штатив з пробірками, скіпка, сірники, мармур або крейда, розчин хлоридної кислоти, вапняна вода.
- Складіть прилад для добування газів і випробуйте його на герметичність. Замість колби можна взяти велику пробірку. У пробірку покладіть кілька шматочків мармуру або крейди і долийте трохи розбавленої хлоридної кислоти.
- Пробірку швидко закрийте корком з відвідною трубкою, кінець якої занурте у пробірку з вапняною водою. Що спостерігається?
- Продовжуйте пропускати газ у цю саму пробірку доти, доки не зникне каламуть і утвориться прозорий розчин. Чому розчин став прозорим?
- Кінець газовідвідної трубки опустіть у порожній стакан або пробірку. Час від часу запаленою скіпкою перевіряйте наявність вуглекислого газу. Що спостерігаєте?
Дайте відповідь на запитання:
- що відбувається при дії хлоридної кислоти на карбонати?
- як двома способами можна довести, що з пробірки виділяється саме вуглекислий газ?
- як пояснити появу каламуті в пробірці з вапняною водою, крізь яку пропускали цей газ і чому ця каламуть зникла? Напишіть рівняння реакцій у молекулярній, повній і скороченій йонних формах.
- як можна добути CO2 в лабораторії?
- при яких умовах карбонати перетворюються на гідрогенкарбонати?
- яка реакція якісна на карбонат-йон?















