Химические элементы Оксиген, Сульфур, Карбон и Фосфор в свободном состоянии существуют в форме нескольких простых веществ.
Термин ввел Я. Берцелиус в 1841 г., что с греческого означает «другие свойства».
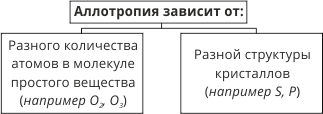
Химический элемент Оксиген образует два простых вещества – кислород и озон, которые являются аллотропными модификациями. Они образованы одним и тем же химическим элементом, но отличаются по составу молекул, физическим и химическим свойствам.
Аллотропные модификации Оксигена
| В природе | В воздухе – 21% (по объему), растворен в воде. | Верхний слой атмосферы – постоянно. На высоте 15-30 км слой толщиной 2-4,5 мм. В нижних слоях атмосферы во время грозы, в хвойных лесах при окислении смолянистых веществ. |
| Ar, | 32 | 48 |
| Физические свойства | Газ бесцветный, без вкуса и запаха tк = –193°С, tпл = –219°С. Плохо растворим в воде (1:3). При –183°С превращается в твердое вещество. | Газ голубой, запах свежести при небольшой концентрации и резкий в концентрированном состоянии, в сжиженном состоянии – темно-синий, в твердом состоянии – цвет до чёрного. Хорошо растворим в воде (1:49), tк = –112°С, tпл = –251,4°С. Добывают в лаборатории с помощью озонатора. |
| Физиологическое действие | Не ядовит. В малом количестве обеспечивает жизненные процессы. | В малом количестве убивает болезненные микроорганизмы, в большом – очень ядовит. |
| Химическая активность | Активный окислитель. | Реакционная способность высокая. Очень сильный окислитель вследствие выделения атомарного Оксигена, не устойчив, взрывается при ударе, обесцвечивает красители, вызывает самовозгорание некоторых веществ. Химическая активность очень высокая. |
| Применение | Дыхание, горение, окисление, заправка ракет (жидкость), сварка и резка металлов, окислитель в металлургии, добывание взрывчатых веществ, HNO3, H2SO4, в медицине. | Дезинфекция воды, воздуха, устранение неприятного запаха, отбеливание тканей, окислитель ракетного топлива, защита планеты от солнечной радиации. |
Озоновый слой и его значение
Озон – это природный надежный защитник всего живого на нашей планете от губительного действия вредного солнечного излучения. У поверхности Земли озона мало. Большая концентрация его днем, весной и летом над полярными частями Земли. На высоте 15-30 км образуется озоновый слой. Он задерживает губительные для всего живого ультрафиолетовые лучи. Вместе с СО2 поглощает инфракрасное излучение Земли и тем самым предотвращает ее охлаждение. Озон очень ядовит. Небольшие концентрации озона в воздухе создают ощущение свежести. Большие дозы вызывают раздражение дыхательных путей, кашель, рвоту, головокружение, утомляемость. Озон разрушает эритроциты крови, вызывает глубокие наследственные изменения в генах человека. Небольшие долговременные дозы приводят к омертвению сердечной мышцы. Концентрация озона в воздухе 0,00001% действует на организм так, как и 250 рентген радиации.
Озон в минимальных дозах, выделенный специальными приборами – озонаторами расщепляет молекулы неприятных запахов в помещении, нейтрализует вредное воздействие электрических и антенных сигналов, световых вибраций, положительно влияет на организм человека.
Карбон существует в виде нескольких аллотропных модификаций, которые отличаются между собой по физическим свойствам. Общее название простых веществ Карбона – углерод. В природе Карбон встречается в основном в виде графита и очень редко – в виде отдельных кристаллов алмаза.
Аллотропные модификации Карбона
|
Карбин -С≡С-С≡С- Фуллерен |
|||
| Физические свойства | Самый твердый, прозрачный, блестящий, сильно преломляет свет, хорошо проводит тепло, не проводит электрического тока, тугоплавкий. Цвет – желтый, бесцветный, коричневый, зеленый, синий голубой. | Кристаллический, мягкий, черный, жирный на ощупь, имеет металлический блеск, хорошо проводит тепло и электрический ток. Отражает свет, тугоплавкий, химически стойкий. | |
| Строение | Тетраэдр. Каждый атом С соединен с четырьмя другими атомами.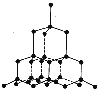 |
Слоистая, гексагональная.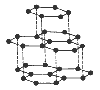 |
|
| Применение | Для сверления твердых пород, изготовления шлифовальных дисков, резцов, сверл, резки стекла. В приборостроении, радиотехнике, изготовлении ювелирных изделий (бриллианты). | Для изготовления огнеупорных тиглей, синтетических алмазов, смазок, электродов, труб, теплообменников, грифелей для карандашей. В ядерных реакторах как замедлитель нейтронов. | |
| Аморфный углерод (мелкие кристаллики графита) | |||
| Добыча | Уголь (С) (растительный и животный). Обугливание древесины без доступа воздуха. | Сажа (С). Сжигание органических веществ при малом количестве воздуха. | Кокс (С). Нагревание каменного угля без доступа воздуха. |
| Применение | Выплавка чугуна и стали, производство черного пороха, красок, для поглощения газов, очистки их. Активированный уголь – в медицине, изготовление противогазов. Как катализатор, очистка сахара от примесей, улавливание ценных органических растворителей. | Изготовление лаков, красок, туши, резины (как наполнитель), ленты для печатных машин, гуталина. | Топливо в доменном процессе, восстановитель в металлургии. Изготовление электродов, легированных сталей. |
Аморфный углерод не принадлежит к отдельным аллотропным модификациям, а представляет собой очень мелкие кристаллики графита.
Для тех, кто хочет знать химию углубленно
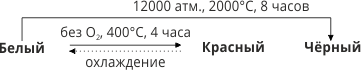
Аллотропные модификации фосфора
Известно несколько аллотропных модификаций фосфора, которые отличаются между собой по физическим свойствам. Существование этих модификаций объясняется различным типом их кристаллических решеток.
Аллотропные модификации фосфора
 |
|||
| Строение, физические свойства |  Полимер, кристаллическая решетка – атомная, порошкообразный. Полимер, кристаллическая решетка – атомная, порошкообразный. |
Подобен графиту, жирный на ощупь, хорошо проводит электрический ток. Добыт в 1934 году американским физиком Бриджменом. | |
| Цвет | Бесцветный с желтоватым оттенком. | Темно-коричневый. | Фиолетовый добыл в 1797 году Мусин-Пушкин. |
| Запах | Часниковий. | Немає. | |
| Плотность | 1,8 | 2,3 | |
| Растворимость | В воде нерастворим, растворим в NH3, CS2, в бензине, легко испаряется | Нерастворим в воде и органических растворителях | Коричневый добыт в лаборатории. |
| Свечение | Светится в темноте. | Не светится. | |
| Воздействие на организм | Очень ядовит, доза 50 мг смертельна. | Не ядовитый. | |
| Химические свойства | Легко окисляется на воздухе, самовозгорается, ожоги на теле плохо заживают. | При нагревании без доступа воздуха возгоняется, смесь с бертолевой солью воспламеняется при малейшем трении, не окисляется на воздухе, горит. | |
| Применение | Производство авиабомб, снарядов, ранее изготавливали статуэтки, в часах, добыча Н3РО4, добыча твердого сплава фосфористой бронзы. | Для изготовления спичек, дымовых завес, фосфорорганических соединений, полимеров, против коррозии, полупроводников, для уничтожения насекомых. | |
Кристаллическая решетка серы молекулярная и состоит из восьмизвенных кольцеобразных молекул S8. Как и все вещества с молекулярной решеткой, сера легкоплавкая: она плавится при температуре, которая только немного больше температуры кипения воды, превращаясь в прозрачную желтую, очень подвижную жидкость. Когда расплавленную серу нагревать дальше, она буреет и теряет подвижность: если опрокинуть сосуд, сера уже не вытекает из него, а медленно стекает с его стенок как смола. От быстрого охлаждения перегретой серы образуется коричневая, просвечивающаяся масса, физическими свойствами подобная резине. Эта аллотропная модификация называется пластичной серой. Итак, если молекулы расположены плотно, образуется аллотропная модификация ромбическая сера. Менее плотная упаковка молекул приводит к образованию моноклинной серы. Молекула пластичной серы — это длинные цепочки из атомов Сульфура. Сильнее нагретая сера закипает и переходит в пар бурого цвета.
Аллотропные модификации Сульфура
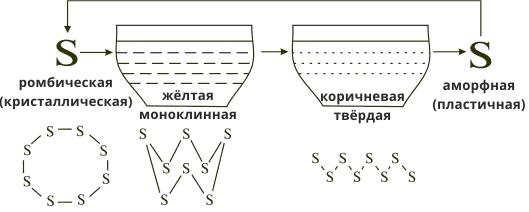
| Лимонно-желтая кристаллическая, молекулы упакованы плотно, хрупкая, ρ = 2,07 г/см3, tпл = 112,8°С. |
Бледно-желтая жидкость, менее плотная упаковка молекул, ρ = 1,96 г/см3, tпл = 119,3°С. |
Темно-коричневая вязкая масса, состоит из длинных цепочек атомов, эластичная, можно вытянуть в нить, не устойчива, быстро загустевает, затвердевает, становится хрупкой. |

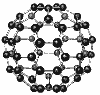 Молекулярная формула С60. Атомы Карбона соединены в кольцо из 20 шестиугольников и 12 пятиугольников в форме футбольного мяча. Добыт в США в 1985 г. Кристаллическое, черное вещество устойчивое на воздухе tпл = 360°C, ρ = 1,65 г/см3. растворимо в органических веществах. Перспектива – производство полупроводниковых пленок.
Молекулярная формула С60. Атомы Карбона соединены в кольцо из 20 шестиугольников и 12 пятиугольников в форме футбольного мяча. Добыт в США в 1985 г. Кристаллическое, черное вещество устойчивое на воздухе tпл = 360°C, ρ = 1,65 г/см3. растворимо в органических веществах. Перспектива – производство полупроводниковых пленок.














