Большинство неметаллических элементов образуют соединения с Гидрогеном; их не образуют только инертные элементы. Бинарные соединения Гидрогена с неметаллами назвали летучими потому, что при обычных условиях они газообразные (HCl, NH3, H2S), или жидкости, легко переходящие в газообразное состояние (HF при температуре 19,5°С и H2O). Эти соединения состоят из молекул. Атомы в них соединены между собой ковалентными полярными связями. Для соединений неметаллических элементов с Гидрогеном чаще всего используют тривиальные названия, реже – химические.
Гидроген хлорид
Гидроген хлорид (хлороводород) – бесцветный газ с резким характерным удушливым запахом. Он в 1,26 раз тяжелее воздуха. При атмосферном давлении и температуре –84°С хлористый водород переходит в жидкое состояние, а при температуре –112°С — затвердевает. Сухой гидроген хлорид не вступает во взаимодействие с металлами, а при наличии следов влаги реакция с активными металлами происходит энергично. В 1 л воды растворяется до 500 л гидроген хлорида образуя хлоридную кислоту. «Туман», появляющийся при попадании гидроген хлорида во влажный воздух – это мелкие капельки хлоридной кислоты. Хлороводород сильно раздражает дыхательные пути, поэтому опыты с ним следует проводить в вытяжном шкафу. Хлоридная кислота относится к сильным кислотам и проявляет все свойства кислот.
Качественная реакция на хлорид-ион. При взаимодействии хлоридной кислоты и хлоридов с раствором аргентум нитрата выпадает сырнисто-белый осадок AgCl нерастворимый в воде и нитратной кислоте. Сокращенное ионное уравнение качественной реакции: Ag+ +Cl– = AgCl↓.
Лабораторный опыт 2. Выявление хлорид-ионов в растворе
Налейте в пробирку хлоридной кислоты, добавьте 2-3 капли раствора аргентум нитрата. Что наблюдаете? Запишите ионно-молекулярное уравнение проведенной реакции. Сделайте вывод о качественной реакции на хлорид-йон.
Добыча. В промышленности добывают гидроген хлорид сжиганием водорода в атмосфере хлора: Н2 + Сl2 = 2HCl↑.
В лаборатории — по реакции обмена между поваренной солью в твердом состоянии и концентрированной сульфатной кислотой при нагревании: 2NaCl + H2SO4 = 2HCl + Na2SO4.
Гидроген хлорид и хлоридную кислоту используют для получения синтетического каучука, пластмассы, очистки поверхности металлов от продуктов коррозии, добычи хлора в лаборатории, переработки руд, осуществления гидролиза целлюлозы, производства хлоридов и других продуктов.
Аммиак
Аммиак NH3 (гидроген нитрид) – бесцветный газ с характерным резким запахом, почти в два раза легче воздуха, очень хорошо растворяется в воде. При обычных условиях в одном объёме воды растворяется около 700 объёмов аммиака. При повышенном давлении или охлаждении до –33,6°С аммиак сжижается, а при –77,8°С затвердевает. Жидкий аммиак имеет большую теплоту испарения, поэтому его используют в холодильных установках. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом.
Физиологическое действие. Вдыхание малых количеств аммиака стимулирует работу сердца и нервной системы, поэтому нашатырный спирт дают нюхать при потере сознания и отравлении угарным газом. Вдыхание больших количеств раздражает слизистую оболочку глаз и дыхательных путей. При попадании в организм вызывает тошноту, понос, смерть от отека гортани. При попадании в глаза вызывает слепоту.
Химические свойства аммиака
Аммиак – активное вещество.
1. Взаимодействие аммиака с кислородом. Аммиак хорошо горит в кислороде, хуже на воздухе. Он горит бледным, зеленоватым пламенем. При горении образуется свободный азот и вода ![]() .
.
В этой реакции аммиак проявляет восстановительные свойства.
При участии катализатора образованный азот также соединяется с кислородом, поэтому продуктами реакции будет нитроген (II) оксид: ![]() .
.
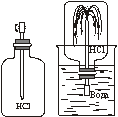
2. Взаимодействие аммиака с водой. Аммиак хорошо растворяется в воде. Если в сухую колбу заполненную аммиаком и закрытую пробкой со вставленной трубкой с вытянутым концом, погрузить в воду, к которой было добавлено несколько капель фенолфталеина, то из бесцветной жидкости начинает бить малиновый фонтан. Аммиак вступает в химическое взаимодействие с водой. В результате реакции образуется гидроксид аммония, о чем свидетельствует изменение цвета индикатора.
В этой реакции к молекуле аммиака от молекулы воды присоединяется атом Гидрогена, в результате чего образуется одновалентная группа атомов NH4, которую назвали «аммоний». Эта группа атомов имеет положительный заряд, поэтому ее еще называют ионом аммония NH4+. Ионы аммония притягивают гидроксид-ионы от молекулы воды, в результате чего образуется гидроксид аммония: NH3 + H-OH ⇄ NH4OH.
Реакция взаимодействия аммиака с водой является обратимой. Молекулы гидроксида аммония распадаются на аммиак и воду, что легко установить по запаху. Чем больше температура раствора, тем реакция в обратном направлении протекает быстрее. При нагревании растворимость аммиака резко уменьшается, и он улетучивается из раствора. Водный раствор аммиака относится к слабым и неустойчивым основаниям.
3. Взаимодействие с кислотами. Аммиак легко взаимодействует с кислотами. В этих реакциях к молекуле аммиака присоединяется атом Гидрогена кислоты и образуется ион аммония, который входит в состав соли. Например, при взаимодействии аммиака с хлоридной кислотой образуется соль аммоний хлорид: NH3 + HCl = NH4Cl.
Образование хлорида аммония можно наблюдать на таком опыте: приблизим друг к другу стеклянные палочки, смоченные, одна – концентрированным раствором нашатырного спирта, вторая – концентрированной хлоридной кислотой (рис. 1) между палочками появляется белый дым. Этот дым состоит из мельчайших кристалликов аммоний хлорида.
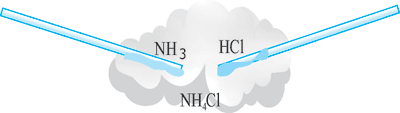
Рис. 1. Взаимодействие хлоридной кислоты с аммиаком
Гидроксид аммония проявляет основные свойства. Он взаимодействует с кислотами и кислотными оксидами:
NH4OH + H2SO4 = NH4HSO4 + H2O
2NH4OH + CO2 = (NH4)2CO3 + H2O
Применение аммиака. Аммиак — один из важных продуктов химической промышленности. Он является исходным веществом для производства нитратной кислоты, нитратных удобрений, взрывчатых веществ, красителей, лекарственных веществ.
Испарения жидкого аммиака используют в холодильных установках для создания искусственного холода. Искусственный холод дает возможность перевозить скоропортящиеся продукты на любые расстояния, хранить их на складах.
В сельском хозяйстве водный раствор аммиака (нашатырный спирт) используют как жидкое азотное удобрение. В быту нашатырный спирт используют для выведения пятен, чистки ювелирных изделий, ковров. Используют в лабораторной практике и медицине.

















