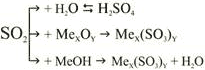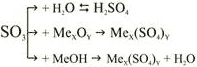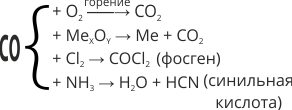Оксиды неметаллических элементов делятся на солеобразующие (их большинство) и несолеобразующие (СО, N2O, NO). По агрегатному состоянию: а) газообразные; б) твердые (P2O5), в) жидкие (H2O, Cl2O7).
В зависимости от валентности, один и тот же неметаллический элемент способен образовывать оксиды разного количественного состава.
Солеобразующие оксиды неметаллических элементов проявляют кислотный характер. Большинство солеобразующих оксидов взаимодействуют с водой образуя кислоты; с основаниями или основными оксидами с образованием соли той кислоты, которая соответствует оксиду.
Гидратными формами оксидов неметаллических элементов являются оксигеносодержащие кислоты.
Сульфур образует два кислотных оксида, которые отличаются составом молекул и свойствами.
Сравнительная характеристика SO2 і SO3
| Состав молекул, название | ||
| Физические свойства | Бесцветный газ с резким удушливым запахом, легко растворяется в воде. При охлаждении до –10°С сжижается в бесцветную жидкость, а при –73°С кристаллизуется. | Бесцветная жидкость, которая при температуре ниже –170°С кристаллизуется, превращаясь в длинные шелковистые кристаллы, сильно поглощает влагу. |
| Химические свойства |
При взаимодействии со щелочами образуется соль и вода. |
При взаимодействии со щелочами образуется соль и вода. При высоких температурах становится неустойчивым и распадается 2SO3 = O2 + 2SO2. |
| Физиологическое воздействие | Токсичен. Небольшая концентрация его в воздухе вызывает раздражение слизистых оболочек дыхательных путей и глаз. Длительное действие даже малых концентраций приводит к возникновению бронхита, гастрита и др., вызывает общее ослабление организма. Обесцвечивает многие органические красители (красная роза становится белой, фиолетовые чернила обесцвечиваются). | Токсичен, вызывает раздражение слизистых оболочек дыхательных путей. При попадании на кожу вызывает тяжелые ожоги. Энергично разрушает органические соединения. |
| Влияние на окружающую среду | Один из основных загрязнителей воздуха. Попадет в воздух в результате сжигания топлива, образования дымовых газов при выплавке металлов, работы автомобильного транспорта (выхлопные газы). |
На воздухе дымит, впитывает влагу из воздуха, образуя белый туман, состоящий из мельчайших капелек сульфатной кислоты. Так появляются «кислотные дожди» вредные для всего живого, для зданий, окружающей среды. В воздухе SO3 может образовываться в результате окисления SO2. |
| Добыча | 1. Горение серы: S + O2 = SO2. 2. Взаимодействием сульфитов с кислотами Meх(SO3)у + HхR → MeхRу + SO2 + H2O. 3. Распад сульфитной кислоты H2SO3 → H2O + SO2. 4. При взаимодействии малоактивных металлов с концентрированной сульфатной кислотой |
Образуется при окислении сернистого газа: 2SO2 + O2 = 2SO3. |
| Применение | Добыча H2SO4, отбеливание соломы, шерсти, шелка. Окуривание овощехранилищ (убивает плесневые грибы), плодов и фруктов, чтобы предотвратить загнивание. | Добыча H2SO4, как водопоглощающее средство. |
| Состав молекул, название | NO – нитроген(II) оксид, монооксид |
NO2 – нитроген(IV) оксид |
| Физические свойства | Бесцветный газ, плохо растворимый в воде, без запаха, несолеобразующий. При низкой температуре сжижается и кипит при –151,8°С, а при –163,7°С переходит в твердое состояние. | Бурый газ с резким характерным запахом, ядовитый, раздражает дыхательные пути, хорошо растворим в воде. Солеобразующий, проявляет свойства кислотных оксидов. |
| Распространение в природе | Образуется в воздухе при взаимодействии азота с кислородом во время грозовых разрядов: N2 + O2 = 2NO. На воздухе легко окисляется, превращаясь в бурый газ NO2: 2NО + O2 = 2NO2. |
В виде «лисьего хвоста» выбрасывается в атмосферу заводами, производящими нитратную кислоту, и является вредным для всего живого. |
| Взаимодействие с водой | С водой не взаимодействует. Малоактивен. |
Взаимодействует с водой с образованием кислот. а) при избытке кислорода образуется только нитратная кислота: 4NО2 + O2 + H2O = 4НNO3; б) при растворении в теплой воде образуется нитратная кислота и NО: 3NО2 + H2O = 2НNO3 + NО; в) хорошо растворяется в воде образуя смесь двух кислот: 2NО2 + H2O = НNO3 + НNО2. |
| Взаимодействие с щелочами | Не взаимодействует. | С раствором щелочи образует соли обеих кислот: 2NО2 + 2NaOH = NaNO3 + NaNО2 + H2O. |
| Взаимодействие с другими веществами | 2NО + SO2 → N2O + SO3 2NО + 2Mg → 2MgO + N2 2NО + O2 → 2NO2 2NО + Cl2 → 2NOCl |
10NО2 + 8P → 4P2O5 + 5N2 2NО2 + 7H2 → 4H2O + 2NH3 |
| Добыча в лаборатории и промышленности | При взаимодействии меди с разбавленной нитратной кислотой, окислением аммиака, азота: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O; 4NH3 + 5O2 → 4NO + 6H2O N2 + O2 → 2NO |
При взаимодействии меди с концентрированной нитратной кислотой, разложением некоторых нитратов: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O 2Pв(NO3)2 → 2PbO + 4NO2 + O2 |
| Состав молекул, название | СО – угарный газ, карбон(II) оксид |
СО2 – углекислый газ, карбон(IV) оксид |
| Mr | 28 | 44 |
| Физические свойства | Газ без цвета и запаха, легче воздуха, практически нерастворим в воде, не сжижается. Его еще называют голубым газом, потому что он горит голубым пламенем. | Газ без цвета и запаха, хорошо растворим в воде, тяжелее воздуха, поэтому его можно переливать из сосуда в сосуд, сжижается при комнатной температуре под давлением, при испарении твердеет в снегообразную массу – «сухой лед». |
| Физиологическое воздействие | Образуется при неполном сгорании топлива, особенно много в выхлопных газах машин. В больших количествах вызывает головокружение, может вызвать удушье, сильную головную боль, тошноту, потерю сознания и даже смерть. | Образуется при дыхании, горении, брожении. Неядовит, но при 3% содержании его в воздухе у человека ускоряется дыхание, вызывает удушье; при 10% – потеря сознания и наступает смерть, при 20% мгновенный паралич. |
| Химические свойства |
Несолеобразующий оксид. Он хорошо горит, выделяя большое количество тепла. Сильный восстановитель. При нагревании восстанавливает металлы из их оксидов. В присутствии угля как катализатора, взаимодействует с хлором с образованием фосгена. С аммиаком образует очень ядовитую синильную кислоту:
Например, восстановление металлов из их оксидов: CO + NiO = Ni + CO2. |
Солеобразующий оксид. Не поддерживает горение и дыхание. Зажженная щепка в нем гаснет. Взаимодействует с водой, щелочами. В нем могут гореть некоторые вещества, образующие с кислородом более прочную связь, чем углерод (например, магний): CO2 + 2Mg = 2MgO + C: Например: CO2+ Н2О ⇄ Н2CO3 CO2 + 2KOH = K2CO3 + H2O CO2 + KOH = KНCO3 CO2 + CaO = CaCO3. |
| Применение | Он входит в состав искусственного газообразного топлива, при получении водорода конверсионным методом, как сильный восстановитель (при извлечении металлов из оксидов), в органическом синтезе. | В холодильной и пищевой промышленности, для создания инертной среды. При электросварке, теплоноситель в ядерных реакторах. Тушение пожаров, повышение урожайности в теплицах, газирование воды, производства соды и сахара, для хранения пищевых продуктов. |
В лабораторных условиях углекислый газ получают действием хлоридной кислоты на мел:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Если пропустить углекислый газ через воду, в которой растворили 1-2 капли раствора лакмуса, через некоторое время раствор покраснеет. Изменение цвета индикатора указывает на образование кислоты:
H2O + CO2 = Н2СО3.
Если продолжать пропускать углекислый газ через образовавшуюся смесь, помутнение исчезает вследствие превращения нерастворимого кальций карбоната в растворимый кальций гидроген карбонат:
CaCO3 + H2O + CO2 = Ca(НСО3)2