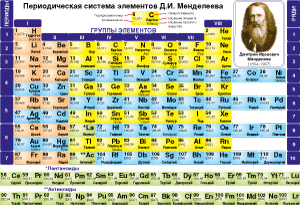
Периодическая система элементов Д.И. Менделеева
В химии, как и в каждой науке, систематизация фактического материала существенно помогает его исследованию. Можно сказать, что современная химия начинает свою подлинную историю с открытием периодического закона химических элементов, принадлежащего великому русскому учёному Д. И. Менделееву. Этот закон и его графическое отображение – периодическая система частей – база исследования химических частей.
Посмотрите на периодическую систему Д. И. Менделеева: каждому элементу отведена отдельная ячейка в таблице. Все элементы пронумерованы. Периодическая система отображает естественную классификацию элементов. Естественный порядок элементов основан на количестве протонов в их ядре и начинается элементом Гидроген. Элемент Гидроген содержит в ядре атома один протон, поэтому ему присвоен порядковый номер один. Элемент номер два – Гелий содержит в ядре два протона. Элемент номер три – Литий содержит в ядре три протона. У каждого последующего элемента становится больше на один протон в ядре.
Каждый элемент занимает то самое место, потому что номер химического элемента в периодической системе равен числу протонов в ядре его атома.
Элементы разместили в ряды и столбики. В ячейке записано символ элемента, его порядковый номер, название элемента, значение относительной атомной массы. В тех вариантах, когда наименования обычных веществ образованных данным элементом и наименования элемента различаются, приведены оба наименования.
Из периодической системы мы будем брать необходимые сведения о химическом элементе.
Масса атома
Химики в лаборатории взвешивают нужные им вещества и традиционно массу выражают в миллиграммах, граммах или килограммах. А можно ли на практике взвесить один атом? Конечно нет! Обычные весы непригодны для определения масс мельчайших частиц вещества – атомов и молекул. Известно, что массы и размеры атомов очень малы. Современные методы исследований позволяют определить очень малые массы атомов с высокой точностью. Например, масса самого легкого из атомов – атома Гидрогена (ma) составляет 1,67·10-27 кг или 0,000 000 000 000 000 000 000 00167 кг, масса атома Оксигена (ma) – 2,655·10-26 кг, 1,993·10-26 кг.
Атомная единица массы
Выполнять расчеты с большими числами неудобно. В этой связи возникла необходимость в единице измерения масс атомов и молекул, удобной для практической работы. Ученые договорились использовать не абсолютные, а относительные атомные массы. Относительная атомная масса является безразмерной величиной и указывает во сколько раз масса данного атома больше некоторой массы, выбранной за эталон. Эталоном первоначально была масса самого легкого атома – атома гидрогена.
Теперь таким эталоном является атомная единица массы (а.е.м.), равная 1/12 массы атома Карбона. Почему 1/12 атома Карбона? Потому что атом Карбона почти в 12 раз тяжелее атома Гидрогена. Эту маленькую массу назвали атомной единицей массы.
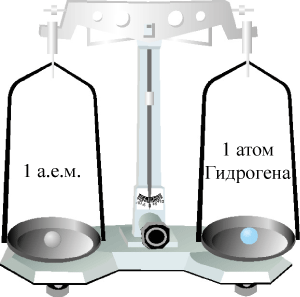
Рис. 39. Относительная атомная масса Гидрогена.
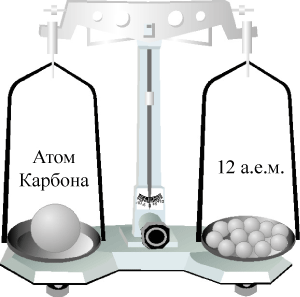
Рис. 40. Относительная атомная масса Карбона.
Как определили атомную единицу массы? Для этого абсолютную массу атома Карбона разделили на 12.
![]()
Относительная атомная масса
Массы атомов всех химических элементов химики сравнивают со значением одного а.е.м. и получают относительные атомные массы. Для этого абсолютные значения атомных масс частей делят на числовое значение атомной единицы массы. Относительная атомная масса обозначается символом Ar («а-эр»), где А – первая буква греческого слова «атомос» – «неделимый», r – первая буква латинского слова «relativus» – «относительный»:
Математическое выражение:
![]() , или
, или ![]() , или
, или ![]() .
.
Пример.
а) Определим относительную атомную массу Натрия:
ma(Na) = 3,8164 · 10–26 кг, тогда
![]()
Итак, Ar(Na) ≈ 23.
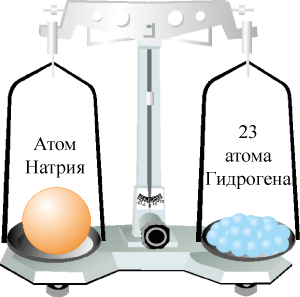
Рис. 41. Относительная атомная масса Натрия.
Пример.
б) Определим относительную атомную массу Гидрогена:
ma(H) = 1,674 · 10–27 кг, тогда
![]()
Итак, Ar(H) ≈ 1.
в) Определим относительную атомную массу Оксигена:
ma(О) = 2,655 · 10–26 кг, тогда
![]()
Итак, Ar(О) ≈ 16.
Это означает, что масса одного атома Гидрогена приближенно равна 1/12 части массы атома Карбона, а масса одного атома Кислорода в 16 раз (заокруглено) больше 1/12 части массы атома Карбона, т.е. за 1 а.е.м. Буквы «а.е.м.» около числового значения относительной атомной массы, как правило, не указывают.
На практике слово «относительная» часто не называют и относительную атомную массу называют просто атомной массой.
Относительные атомные массы определены для всех элементов и указаны в периодической системе элементов. Мы будем пользоваться заокругленными атомными массами. Если после запятой стоит число больше пяти, мы добавим единицу, а если меньше пяти – мы его учитывать не будем. За исключением атома хлора, для которого принимаем Ar(Cl) = 35,5.
Пример.
| Название химического элемента | Абсолютная масса атома, кг | Масса атома (а.е.м.) | Относительная атомная масса (заокругл.) |
| Гидроген | 1,674 · 10–27 | 1,00794 | 1 |
| Оксиген | 2,655 · 10–26 | 15,9994 | 16 |
| Сульфур | 5,32 · 10–26 | 32,06 | 32 |
Итог
- Атомная единица массы представляет собой величину, равную 1/12 массы атома Карбона.
- Относительная атомная масса – это физическая величина, определяемая отношением массы атома к 1/12 части массы атома Карбона.
- Значение относительной атомной массы и массы атома выраженной в а.е.м. численно совпадают.
?
- Какие сведения об элементах мы можем извлечь из периодической системы?
- Каково числовое значение атомной единицы массы?
- Что такое относительная атомная масса элемента?
- Почему под порядковым номером элемента понимается протонное число?
Любознательным
Атомную массу можно получить суммируя массы протонов и нейтронов. Поскольку масса протонов и нейтронов в атомных единицах массы выражается целыми числами, то масса атомов должна выражаться целым числом. Почему у большинства химических элементов атомные массы дробны? Это объясняется тем, что в ядрах атомов того же химического элемента может быть разное количество нейтронов. Атомы того же элемента, отличающиеся массой, называют изотопами. Слово происходит от греческих слов «isos» – «одинаковый» и «topos» – «место», что подчеркивает принадлежность таких атомов тому же месту в периодической системе.
Относительная атомная масса элементов является средним арифметическим масс изотопов и с учетом их распространения в природе.
Количество нейтронов оказывает влияние только на массу атома. Важнейшей чертой атома является количество протонов в ядре (заряд ядра).
Для тех, кто хочет знать химию глубже
1. Могут ли в состав любой молекулы входить следующие массы Оксигена:
а) 8 а.о.м;
б) 16 а.о.м;
в) 64 а.о.м;
г) 24 а.о.м?
Объясните.
Ответ: масса одного атома Оксигена равна 16 а.е.м. Число атомов в молекуле может быть только целым, поэтому:
а) 8 а.е.м. быть не может, потому что это соответствует 1/2 атома Оксигена.
б) 16 а.е.м. может быть, потому что это соответствует одному атому Оксигена.
в) 64 а.е.м. может быть, потому что это соответствует 4 атомам Оксигена.
г) 24 а.е.м. не может быть, потому что это соответствует 1,5 атома Оксигена.