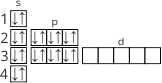Химический элемент характеризуют указывая его место в периодической системе, строение атома, тип элемента, характер оксида и гидроксида, возможную валентность, дают сравнительную характеристику.
По месту в периодической системе можно охарактеризовать любой химический элемент и получить о нем следующие данные:
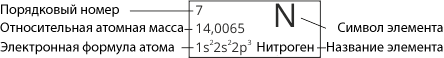
По положению элемента в периодической системе можно определить устройство его атома, семью элемента и его валентность, свойства простого вещества этого элемента и его соединений.
Пользуясь периодической системой элементов, дадим характеристику металлического элемента Кальция.
|
Порядковый номер, заряд ядра, Аr |
20, +20, Аr =40 |
|
Место в ПС |
Кальций размещен в 4-м периоде, II группе, главной подгруппе |
|
Строение атома |
Электронная оболочка состоит из четырех слоев (4-й период), содержащих 20 электронов. На внешнем энергетическом уровне находится 2 электрона (номер группы). Электронная схема атома: |
|
Тип элемента, активность |
На внешнем энергетическом уровне атома Кальция содержится 2 электрона, следовательно это металлический элемент, химически активный. Валентность его – II |
|
Летучее соединение с Гидрогеном |
Летучего соединения с Гидрогеном Кальций не создаёт |
|
Формула высшего оксида, его характер |
Его высший оксид CaO обладает оснóвными свойствами |
|
Гидроксид, что ему отвечает, его характер |
Ему отвечает гидроксид Ca(OH)2 |
|
Сравнение со свойствами стоящих рядом элементов в периоде и подгруппе |
Зная, как изменяются свойства элементов в пределах групп и периодов, можем сравнить Кальций с окружающими его элементами. Поскольку у атома Кальция больше заряд ядра, чем у Калия и меньше, чем у Скандия, то металлические свойства Кальция слабее Калия и сильнее Скандия: K > Ca > Sc. Поскольку радиус атома Кальция больше, чем Магния и меньше Стронция, то металлические свойства у Кальция сильнее, чем у Магния, но слабее, чем у Стронция: Mg < Ca < Sr |
Характеристику неметаллического элемента рассмотрим на примере Нитрогена
|
Порядковый номер элемента, его название и относительная атомная масса: |
№ 7, Нитроген, Ar(N) = 14 |
|
№ периода, ряда, группы, подгруппы: |
2 период, 2 ряд, V группа, главная подгруппа |
|
Заряд ядра (количество протонов), количество нейтронов и электронов: |
7. ē = 7, p+ = 7, n0 = 7 |
|
Електронная формула: |
1s22s22p3 |
|
Електронная конфигурация атома: |
|
|
Валентность: |
ІІІ |
|
Активность: |
Неметаллический элемент, малоактивный |
|
Летучее соединение с Гидрогеном |
NH3 |
|
Формула высшего оксида, его характер: |
N2O5 (кислотный) |
|
Соответствующее гидратное соединение: |
HNO3 (кислота) |
|
Сравнение со свойствами стоящих рядом элементов в периоде и подгруппе: |
Неметаллические свойства сильнее выражены, чем у Карбона и Фосфора, но слабее, чем у Оксигена. |